Produkcja szczepionek wektorowych.
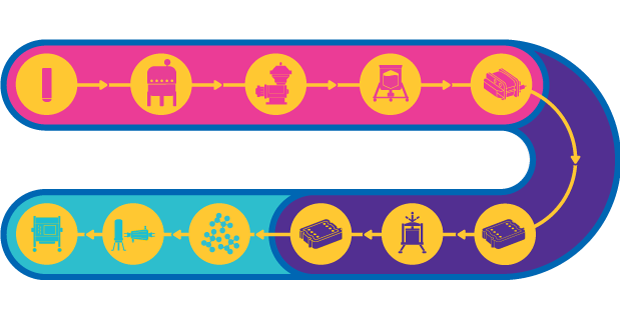
Pociąg procesowy dla szczepionek z wektorem wirusowym
Żywa szczepionka wektorowa wykorzystuje atenuowany lub nieszkodliwy mikroorganizm, taki jak adenowirus, do przenoszenia części antygenu w celu stymulowania odpowiedzi immunologicznej. Szczepionki wektorowe są zdolne do wywoływania silnej odporności komórkowej, która jest niezbędna w przypadku złożonych chorób, takich jak AIDS, malaria i rak.
Chociaż proces produkcji wektorów szczepionkowych jest dość szablonowy, mogą pojawić się pewne wyzwania, ponieważ można użyć kilku różnych wirusów o różnych właściwościach. W przypadku dużych wektorów wirusowych sterylność procesu ma kluczowe znaczenie ze względu na utratę wydajności związaną ze sterylną filtracją. Istnieją również wyzwania związane z agregacją i stabilnością wektora.
Ponadto wiele procesów fazy I/II obejmuje przylegające kultury komórkowe; w rezultacie skalowanie do fazy III i produkcji komercyjnej może wymagać dostosowania procesu w celu osiągnięcia celów produkcyjnych. W późniejszych fazach wydajność i czystość produktu mają krytyczne znaczenie, ponieważ w produkcie końcowym wymagane są wysokie miana dawek. Dowiedz się więcej o produkcji szczepionek wektorowych.
Powiązane artykuły techniczne
- Ten artykuł techniczny przedstawia proces produkcji szczepionki adenowirusowej i zawiera studium przypadku dotyczące opracowania przyspieszonej i opłacalnej szczepionki wektorowej adenowirusowej jednorazowego użytku.
- Indywidualnie zaprojektowany model kosztów jest wykorzystywany do badania ekonomiki produkcji szczepionek w kilku różnych modalnościach, w tym mRNA. Model umożliwia lepsze zrozumienie procesu, symuluje wąskie gardła i pomaga zoptymalizować wydajność produkcji.
- This page shows how to purify or remove viruses with a Capto DeVirS, AVB Sepharose High Performance from Cytiva.
- Nasz przegląd skalowalnej filtracji w przepływie stycznym do produkcji wektorów wirusowych dostarczy kluczowych rozważań na temat opracowywania i optymalizacji procesu końcowego.
- Zobacz wszystkie (1)
Znajdź więcej artykułów i protokołów
Przyspieszenie czasu do etapu klinicznego przy jednoczesnym zapewnieniu niezawodnego skalowania
Procesy hodowlane opracowane w celu produkcji szczepionek wektorowych muszą być zoptymalizowane, aby spełnić wymagania dotyczące wydajności. Optymalizacja ta obejmuje etapy lizy i klarowania komórek, które są niezbędne do usunięcia komórek i resztek komórkowych oraz zapewnienia solidnego zbioru wektorów. Proces poprzedzający jest jednak skuteczny tylko wtedy, gdy można go niezawodnie skalować w celu zaspokojenia przewidywanego popytu na rynku.
Osiągnij cele wydajności i wydajności dzięki solidnemu usuwaniu zanieczyszczeń
Kwasy nukleinowe z lizowanych komórek są powszechnym zanieczyszczeniem w procesach szczepionek wektorowych. Przepisy wymagają, aby poziom przenoszonego kwasu nukleinowego z komórek gospodarza był niższy niż 10 ng/dawkę atenuowanej szczepionki wirusowej. Obróbka endonukleazą Benzonase®, a następnie filtracja w przepływie stycznym to solidne i wydajne połączenie do degradacji i usuwania resztkowych składników kwasu nukleinowego.
Maximize Downstream Recovery
Produkcje kliniczne na małą skalę są zazwyczaj oczyszczane przy użyciu ultrawirowania w gradiencie gęstości opartym na CsCl, podczas gdy produkcja na dużą skalę wymaga dwu- lub trzystopniowego procesu chromatografii. Wymiana anionowa jest zwykle stosowana do usuwania HCP, DNA, RNA i innych głównych zanieczyszczeń, podczas gdy chromatografia wykluczania wielkości jest stosowana do usuwania śladowych zanieczyszczeń.
Zapewnienie bezpieczeństwa pacjenta
Filtracja sterylna zapewnia sterylność końcowego produktu i bezpieczeństwo pacjenta. Aby wyeliminować zanieczyszczenia mikrobiologiczne, wymagany jest rozmiar porów filtra wynoszący 0,22 µm lub mniej. Kluczową kwestią w procesie sterylnej filtracji jest poziom agregatów wirusowych. Agregaty te muszą być kontrolowane poprzez optymalizację receptury, w przeciwnym razie proces sterylnej filtracji będzie stanowił wyzwanie z możliwością dużych strat w wydajności.
Obróbka nukleazą i klarowanie
Zapewnia solidną skalowalność.
- Obróbka nukleazą® odpowiednią do produkcji biofarmaceutycznej EMPROVE® Bio
- Benzonase® Detection with Benzonase® Elisa Kit II to Detect Left Over Benzonase® endonukleazy w procesie
- Pierwotne/wtórne klarowanie za pomocą filtrów wgłębnych Millistak+® HC POD
- Primary Clarification with Clarisolve® Depth Filters
- Clarification Depth Filters & Pretreatment Solutions
- Klarowanie za pomocą filtrów Milligard® PES

Filtracja z przepływem stycznym
Osiągnij cele w zakresie wydajności, efektywności i odzysku pDNA, zapewniając jednocześnie skuteczne usuwanie zanieczyszczeń.
- Ultrafiltracja / Diafiltracja z kasetami Pellicon® 2
- Ultrafiltracja / Diafiltracja z Pellicon® 3 Kasety
- Ultrafiltracja / Diafiltracja z Pellicon® Capsule z Ultracel® Membrane
- Mobius® TFF 80 System, Mobius® FlexReady Solution for TFF, Cogent® Lab Systems i Cogent® Process-scale Tangential Flow Filtration System
Chromatografia downstream
- Chromatografia membranowa z żywicą Eshmuno® Q Resin
- Chromatografia membranowa z membranami Natrix® Q Recon Mini Chromatography
- Membrana do chromatografii membranowej Natrix® Q Pilot
- Chromatografia membranowa z Natrix® Q Recon Mini
- Chromatografia membranowa z Eshmuno® Q Resin
- Capture and/or Polishing Chromatography with Fractogel® EMD DEAE Chromatography Resins
- Capture and/or Polishing Chromatography with Fractogel® EMD DMAE Chromatography Resins
- Mobius® FlexReady Solution for Chromatography


Płynne pożywki i bufory do hodowli komórkowych w bioprzetwarzaniu
Oferujemy najwyższą w branży jakość sterylnych, filtrowanych płynów, dostarczając gotowe do użycia pożywki do hodowli komórkowych, bufory, produkty CIP i SIP z zakładów GMP na całym świecie w celu optymalizacji produkcji biofarmaceutycznej.
Końcowa sterylna filtracja i napełnianie
Zapewnij bezpieczeństwo pacjentów dzięki niezawodnemu i solidnemu procesowi sterylnej filtracji.
Oprogramowanie analityczne i technologia PAT
Powiązane zasoby
- Application Guide: Biopharmaceutical
A search tool to help you overcome your manufacturing challenges.
- Mini-Handbook: Viral Vector Vaccine Bioprocessing
The manufacturing process for adenovirus vectors is straightforward and fairly templated; a general outline is explained in this handbook.
- White Paper: Developing an Accelerated and More Cost-Effective Single-Use Adenoviral Vector Vaccine Manufacturing Process
Our collaboration with the Jenner Institute has resulted in a single-use, scalable GMP template for manufacture of adenoviral-based vaccines. Learn more on this faster and more cost-effective approach to vaccine manufacturing.
- Application Note: Effect of Benzonase® Endonuclease Addition to Purification of Sabin Polio Virus Type 3
This Application Note summarizes the benefits of incorporating Benzonase® endonuclease in a polio virus type 3 production process.
- Article: Robust Harvest Clarification For Adeno-Associated Viral Vectors Via Depth Filtration
We demonstrate that depth filters clarify AAV vectors, helping to overcome the unique separation challenges presented by these important vectors for gene therapy.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?




