Proces produkcji szczepionki adenowirusowej
Czym są adenowirusy
Adenowirusy to nieotoczkowane wirusy z ds-DNA o wielkości 70-90 nm. Są skuteczne w transdukcji komórek docelowych i mogą być produkowane w wysokich mianach (1011/ml). Adenowirus (AV) w swojej normalnej postaci jest patogenem powodującym dolegliwości układu oddechowego, takie jak zapalenie spojówek i przeziębienie. Jest on również zdolny do infekowania neuronów, uszkadzania komórek i wywoływania silnych odpowiedzi immunologicznych. Jednak adenowirusy stosowane jako wektory są specjalnie zaprojektowane, aby nie powodować żadnych chorób i są ogólnie uważane za bezpieczne.
Przezwycięża istniejącą odporność na wektory adenowirusowe przy użyciu wektorów pochodzących od Simian
Chociaż wektory adenowirusowe wywołują zarówno wrodzoną, jak i adaptacyjną odpowiedź immunologiczną, główną wadą tych wektorów jest istniejąca wcześniej odporność na nie. Ponad pięćdziesiąt serotypów adenowirusa infekuje ludzi, a ponad 80% populacji było narażone na co najmniej jeden serotyp i rozwinęło odpowiedź immunologiczną specyficzną dla serotypu. Ta istniejąca wcześniej odporność przeciwko wektorowi może znacznie zmniejszyć odpowiedź immunologiczną na ładunek wektora (antygen patogenu wyrażony z transgenu wprowadzonego do wektora).
W ostatnich latach rozwój szczepionek adenowirusowych badał wykorzystanie wektorów adenowirusowych pochodzących od małp, które mają znikomą seroprewalencję w populacji ludzkiej. Przezwyciężając problem istniejącej wcześniej odporności przeciw wektorom, zachowują one zalety innych adenowirusów niekompetentnych do replikacji:
- Indukcja szerokiej komórkowej i humoralnej odpowiedzi immunologicznej przeciwko docelowemu antygenowi
- Bezpieczeństwo, bez replikacji wirusa u biorcy szczepionki z powodu delecji niezbędnych genów
- Brak integracji genomu gospodarza
- Skuteczna infekcja różnych typów komórek ssaków, w tym komórek prezentujących antygen
- Kompatybilność z różnymi technologiami przetwarzania, w tym bioreaktorami z mieszanym zbiornikiem, metodami filtracji o wysokiej wydajności i procedurami oczyszczania chromatograficznego w wyniku ich neutralnego ładunku i stosunkowo niewielkich rozmiarów. Rozmiar ten (c 80-90 nm) jest kompatybilny z końcową sterylną filtracją (0,2 µm), eliminując potrzebę zatwierdzonego i uciążliwego zamkniętego przetwarzania.
Zobacz nasze studium przypadku dotyczące opracowania szybkiego, skalowalnego i zgodnego z GMP procesu produkcji szczepionek na bazie wektorów adenowirusowych ssaków sympatycznych./p>
Proces produkcji szczepionek wirusowych na bazie adenowirusów
Proces produkcji wektorów adenowirusowych jest prosty i dość szablonowy; ogólny zarys przedstawiono na rysunku 1. Typowy rozmiar bioreaktora w skali pilotażowej do produkcji adenowirusów to 20 l hodowli komórkowej, która staje się ~ 4 l po UF/DF i ~ 500 ml po chromatografii i końcowej sterylnej filtracji. Objętości procesu w pełnej skali wahają się od 100 do 200 l, a ogólna wydajność procesu wynosi zazwyczaj 65%.

Rysunek 1.Ogólny proces szczepionki wektorowej opartej na adenowirusie. A: Przygotowanie pożywki i inokulum B: Wzrost komórek w bioreaktorze Inokulacja wirusów C: Oczyszczanie D: Obróbka nukleazą E: Ultrafiltracja/diafiltracja F: Oczyszczanie wirusa G: Ultrafiltracja/diafiltracja H: Filtracja końcowa
Hodowla komórkowa do produkcji wektorów adenowirusowych
Wydajne wytwarzanie wektorów adenowirusowych można osiągnąć przy użyciu genetycznie zmodyfikowanych ludzkich linii komórkowych, które uzupełniają usunięte geny adenowirusowe wymagane do replikacji (np. komórki 293-ORF6, HEK293, PER.C6). Komórki te mają dobrze scharakteryzowany profil bezpieczeństwa i mogą być przystosowane do wzrostu w zawiesinie bez surowicy. Komórki produkcyjne są hodowane w bioreaktorach ze zbiornikiem mieszanym z pożywką bez surowicy.
Podczas fazy infekcji adenowirusem, procesy metaboliczne linii komórek produkcyjnych są znacznie zwiększone w celu wsparcia produkcji wektorów. Aby ułatwić pomyślną produkcję wektora, przeprowadzany jest etap wymiany pożywki w celu usunięcia zużytej pożywki zawierającej metabolity, takie jak kwas mlekowy, które mogą być szkodliwe dla produkcji wirusa. Wydajność wirusa znacznie spada, gdy pH pożywki wynosi 7. Typowa gęstość komórek 50-100% podczas infekcji adenowirusem wynosi 0,5-9,0 x 106 komórek/ml. Miano adenowirusa podczas zbioru zwykle waha się od 109 do 1011 pfu/mL.
Liza komórek i klarowanie w celu zebrania adenowirusa
Komórki są lizowane mechanicznie lub za pomocą chemicznego środka lizującego (np, niejonowy detergent) w celu pozyskania adenowirusów. Najczęściej stosuje się lizę roztworem Triton™ X-100. Klarowanie przeprowadza się w celu usunięcia komórek lub resztek komórek i zebrania adenowirusów. Filtr wgłębny jest powszechnie stosowany do wstępnego oczyszczania. Niektórzy producenci stosują również filtrację z przepływem stycznym (TFF) w warunkach niskiego ścinania, filtrację wgłębną lub filtrację z przepływem normalnym (NFF) do klarowania zbiorów szczepionek adenowirusowych. Wydajność filtrów zależy od gęstości komórek podczas zbioru, stopnia lizy i rozkładu wielkości cząstek. Typowe zmętnienie lizatu wynosi 200 NTU. Podobnie jak w przypadku procesu produkcji szczepionek wirusowych, w tym zastosowaniu powszechnie stosuje się filtr wgłębny, a następnie filtr redukujący obciążenie biologiczne. TFF może być również opcją dodatkową do opcji NFF. Typowe obciążenie dla TFF wynosi 20-30 l/m2. Niektórzy producenci stosują również wirowanie do wstępnego oczyszczania. Filtrat z oczyszczania wtórnego był w niektórych przypadkach filtrowany przez 0,45 µm w celu redukcji obciążenia biologicznego (~250-500 l/m²). Zmętnienie po klarowaniu mieści się w zakresie 5-10 NTU. Ta operacja urządzenia jest przeprowadzana w temperaturze pokojowej.
Obróbka nukleazą w celu usunięcia zanieczyszczających kwasów nukleinowych
Kwas nukleinowy pochodzący z lizowanych komórek jest kluczowym zanieczyszczeniem w procesach szczepionek adenowirusowych i może zakłócać oczyszczanie wirusa. Wirusy namnażane w komórkach innych niż ludzkie (np. HEK293, PER.C6) stwarzają większe ryzyko przeniesienia kwasu nukleinowego. Przepisy wymagają, aby zawartość kwasu nukleinowego w komórkach gospodarza wynosiła poniżej 10 ng/dawkę atenuowanej szczepionki wirusowej.1 U/ml benzonazy® endonukleazy w temperaturze 30-34 °C przez cztery do ośmiu godzin.
Ultrafiltracja/diafiltracja
Po obróbce endonukleazą Benzonase® zbiór jest diafiltrowany przy użyciu TFF (urządzenia UF 100-300 kDa). Typowy strumień dla 300 kDa wynosi ~25-50 LMH przy 5-10 psi TMP i natężeniu przepływu 5-7 l/min/m2. Następnie wykonuje się zagęszczanie 4-10 X i diafiltrację 5-8 N. Typowa retencja adenowirusów wynosi ponad 99%. Niektórzy producenci wykonują etap zatężania wektora w celu zmniejszenia całkowitej objętości przed obróbką endonukleazą Benzonase®. Diafiltracja jest następnie wykonywana w celu ułatwienia wymiany buforu do dalszego przetwarzania, takiego jak dalsze przetwarzanie chromatograficzne. Czasami przed dalszym oczyszczaniem stosuje się etap zatrzymania na noc. W związku z tym przeprowadzany jest etap filtracji w celu zmniejszenia ryzyka obciążenia biologicznego i ochrony kolumn chromatograficznych.
Metody chromatograficzne do oczyszczania adenowirusów
Partie kliniczne na małą skalę są zazwyczaj oczyszczane przy użyciu ultrawirowania z gradientem gęstości opartym na CsCl. Jednak w przypadku produkcji na dużą skalę stosuje się chromatografię kolumnową. Do produkcji adenowirusów zwykle stosuje się dwu- lub trzystopniowe oczyszczanie metodą chromatografii kolumnowej. Powszechnie stosowanymi metodami oczyszczania są wymiana jonowa i chromatografia wykluczania (opcjonalnie). Wymiana anionowa jest stosowana do usuwania HCP, DNA, RNA i innych głównych zanieczyszczeń. Chromatografia wykluczania wielkości jest stosowana do usuwania śladowych zanieczyszczeń. Zazwyczaj w kolumnach anionowymiennych substrat adenowirusa (5 × 1012 cząstek wirusa/mL żywicy) jest ładowany z szybkością przepływu 75 cm/godz. w 50 mM Tris-HCl, pH 8,0 w 5% glicerolu i eluowany w gradiencie soli. Adenowirus eluuje przy sile jonowej 40 mS/cm. Słabe wymieniacze jonowe sprawdzają się również w oczyszczaniu adenowirusów, zapewniając wysoką czystość i wydajność.
Filtracja sterylna
Filtracja sterylna zapewnia sterylność końcowego produktu. Rozmiar porów filtra 0,22 µm lub mniejszy jest wymagany do wyeliminowania zanieczyszczeń mikrobiologicznych.
Studium przypadku: Opracowanie przyspieszonego i bardziej opłacalnego procesu produkcji szczepionki z wektorem adenowirusowym jednorazowego użytku w ramach współpracy publiczno-prywatnej
W tym studium przypadku współpracowaliśmy z Jenner Institute, Oxford University w Wielkiej Brytanii, aby opracować zoptymalizowany, jednorazowy proces GMP do produkcji szczepionek opartych na wektorach adenowirusowych, w tym tych ukierunkowanych na powszechne patogeny, takie jak wścieklizna i pojawiające się zagrożenia, takie jak Zika i Ebola. Naszym celem było udoskonalenie procesu produkcji szczepionek opartych na adenowirusach dla materiałów fazy 1 w skali 5x1013 VP (cząstek wirusa; odpowiednik 2000 dawek), który mógłby być następnie łatwo skalowalny do 5x1014 VP. Staraliśmy się opracować opłacalny i możliwy do przeniesienia szablon o co najmniej 50% ogólnej wydajności, który mógłby zostać wykorzystany do przyspieszenia rozwoju i produkcji szczepionek na całym świecie. Pierwszym kandydatem ocenianym jako pilotażowy była szczepionka przeciwko wściekliźnie.
Solidniejszy szablon do produkcji wektorów adenowirusowych oparty na łatwym w obsłudze i łatwym do wdrożenia procesie jednorazowego użytku GMP może przynieść szereg korzyści, w tym:
- Przyspieszenie faz klinicznych
- Skrócenie czasu wprowadzenia produktu na rynek
- Umożliwienie szybszej reakcji na epidemie i pandemie
- Zaspokojenie zapotrzebowania na bardziej przystępne cenowo leki w miejscach o niskich zasobach<
Przejście na nowy szablon produkcyjny koncentrowało się na zmniejszeniu potrzeby obsługi i kompresji procesów w celu odejścia od pracochłonnych operacji związanych z ryzykiem. Staraliśmy się wyeliminować kolby wstrząsane, które muszą być otwierane w procesie ręcznym, wirowanie ze względu na związaną z tym konserwację, inwestycje i wyzwania związane ze skalowalnością oraz ultrawirowanie.
Nowy szablon skompresował proces do siedmiu kroków i zmaksymalizował wykorzystanie technologii jednorazowego użytku. Ponadto naszym celem było opracowanie szablonu, który może być wykorzystywany do produkcji różnych wektorów adenowirusowych i przetestowanie dwóch innych kandydatów równolegle ze szczepionką przeciwko wściekliźnie.
Upstream Processing with Single-use Bioreactors
Dla nowego procesu upstream, Trzylitrowe bioreaktory Mobius® i inne bioreaktory jednorazowego użytku zostały uruchomione w trybie wsadowym po zaszczepieniu zestawem nasion HEK293 T-rex. Znaczący wzrost wydajności uzyskano poprzez konwersję z kolb wstrząsanych do bioreaktorów jednorazowego użytku. Wydajność procesu na jedno naczynie bioreaktora wahała się od 7,2x1013 do 2,5x1014 VP (qPCR) w jednej serii z ChAdOx2 RabG, dwóch seriach z ChAdOx1 RVF i dwóch seriach z ChAd63 ME-TRAP, tj. 2500 ludzkich dawek ok. 2,5x1010 VP.
Redukcja DNA
Trawienie kwasu nukleinowego w celu spełnienia wymogów regulacyjnych i ułatwienia dalszych procesów zostało przeprowadzone przy użyciu nukleazy Benzonase®. Dodanie nukleazy w stężeniu 60 U/ml pożywki do hodowli komórkowej zmniejszyło poziom DNA komórek gospodarza 1500-krotnie podczas dwugodzinnej lizy w bioreaktorze, spełniając wymóg regulacyjny 10ng/dawkę. Cały proces został skompresowany, ponieważ liza została przeprowadzona bezpośrednio w bioreaktorze. Jak pokazano w tabeli 1, liza była wystarczająca już po 30 minutach, osiągając docelową wartość 10ng/dawkę; po dwóch godzinach redukcja jest ponad 1500-krotna. W świetle wyników jest prawdopodobne, że niższe stężenie wystarczyłoby do osiągnięcia 10 ng/dawkę i trawienia DNA < 200 par zasad. Dalszą optymalizację można przeprowadzić w celu osiągnięcia wystarczającego trawienia DNA w zadowalającym czasie przy użyciu dawki nukleazy Benzonase® bardziej odpowiedniej do skalowalności.
Usunięcie DNA i jego wpływ na lepkość zmniejszyło również potencjał zatorów i potrzebę większego obszaru filtracji w dalszych operacjach.
Zastąpienie wirowania w dalszym przetwarzaniu za pomocą jednorazowych filtrów wgłębnych
W tym nowym procesie zastąpiliśmy wirowanie klarowaniem za pomocą filtrów wgłębnych, które są jednorazowe i używane w normalnej filtracji przepływowej, a zatem łatwe w obsłudze. Ponieważ klarowanie ma silny wpływ na kolejne etapy, staraliśmy się osiągnąć jak najwyższy odzysk, w tym przypadku powyżej 90% wraz z redukcją zmętnienia.
Chociaż wektory adenowirusowe są neutralne, nadal chcieliśmy przetestować różne filtry i wybrać najlepszą opcję, aby zmaksymalizować odzysk adenowirusów. Tabela 2 opisuje trzy filtry wgłębne Millistak+® i dwa filtry wgłębne Clarisolve®, które zostały przetestowane; każdy z nich był innej klasy, klasy mikronowej i ładunku.
Rysunek 2 podsumowuje naszą ocenę różnych filtrów wymienionych w Tabeli 2. Odzyskiwanie wirusa było podobne dla wszystkich i osiągnęło nasz cel >90% mierzony metodą qPCR. Wysokowydajny filtr Millistak+® HC Pro COSP działał najlepiej pod względem przepustowości redukcji zmętnienia; osiągnęliśmy jednostopniową redukcję zmętnienia z 70 do 7 NTU. Ponadto byliśmy w stanie przetworzyć więcej niż 2,3 l bez osiągnięcia rzeczywistego końcowego punktu ciśnienia (Pmax). W testach na małą skalę nigdy nie osiągnęliśmy prawdziwego Pmax, co jest metodologią stałego strumienia z monitorowaniem ciśnienia. Następnie roztwór przeszedł przez etap redukcji obciążenia biologicznego przy użyciu Opticap® XL 150 Millipore Express® 0.2 mikrony przed przejściem do oczyszczania.
Aby wyeliminować wymóg ultrawirowania na tym etapie, zdecydowaliśmy się na filtrację z przepływem stycznym. Osiągnęliśmy 80-88% odzysk produktu i 20-30-krotną redukcję zanieczyszczeń białkami komórek gospodarza przy użyciu następującej metody:
- 300 kDa Pellicon® 2 Mini filter (0.1m2) z membraną Biomax®
- 5L objętości początkowej po oczyszczeniu (Millistak+® 10x stężenie objętościowe)
- 10 DV filtracji z buforem odpowiednim dla IEX (zawierającym 100 mM NaCl)

Figure 2.Evaluation of virus recovery using different depth filters. The Millistak+® HC Pro COSP performed best in terms of turbidity reduction and virus recovery. A: Throughput (L/m2) B: chAdOx2-RabG – Titers after primary clarification VP/mL (smale scale trials) C: Virus titers after clarification with Millistak+® HC Pro C0SP (VP/mL) (2-4 L scale)
Kluczowym czynnikiem podczas wykonywania filtracji w przepływie stycznym i czymś, co zalecamy podczas obsługi wirusów z "otwartymi" membranami (100 kDa MWCO, potencjalnie umożliwiającymi wysoki strumień i wysokie frakcje konwersji nawet przy niskim ciśnieniu transmembranowym (TMP), jest kontrola permeatu. Kontrola permeatu jest wykonywana poprzez dodanie pompy lub zaworu w celu częściowego ograniczenia miejsca permeatu, aby uniknąć tworzenia niekontrolowanej warstwy polaryzacyjnej. Gdy TMP jest stabilne, wirusy poddawane są mniejszym naprężeniom, co pomaga zapewnić lepszą regenerację i zmniejszyć zanieczyszczenie (rysunek 3).
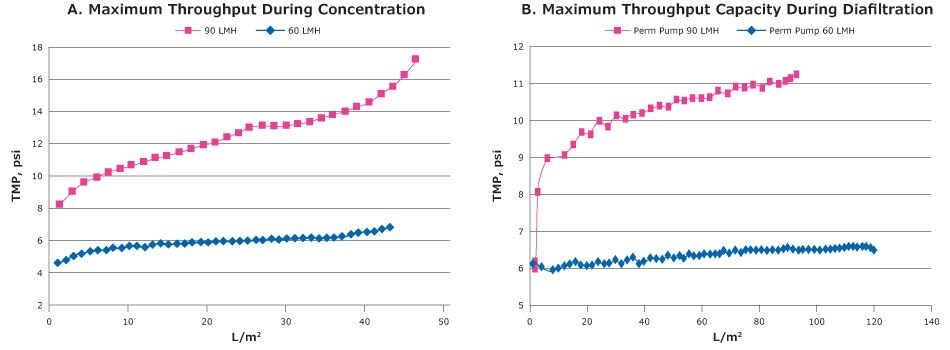
Figure 3.Small scale trials of the Tangential flow filtration experiment with clarified lysate of ChadOx2-RabG using 300 kDa MWCO Biomax® PESC-screen Pellicon® 2 Mini cassette. A: TMP excursion during concentration B: TMP excursion during diafiltration.
Celem etapu chromatografii było użycie jednorazowych membran zamiast żywic, które muszą być pakowane, czyszczone i walidowane. W tym celu wykorzystaliśmy nasze Membrana chromatograficzna Natrix® Q, czwartorzędowa amina szczepiona na makroporowatej membranie polipropylenowej pokrytej hydrożelem. Konstrukcja ta łączy w sobie zalety tradycyjnych żywic i membran absorpcyjnych, prowadząc do wysokiej wydajności i szybkich prędkości przepływu, co pozwala nam jeszcze bardziej skompresować proces i obniżyć koszty. Technologia ta jest bardzo wszechstronna i może być stosowana w trybach przepływu lub bind-elute, z wymianą jonową i metodami powinowactwa. W przypadku tego procesu oceniliśmy wersję z wymianą anionową i przeprowadziliśmy chromatografię w trybie bind-elute przy użyciu parametrów podanych w Tabeli 3.
Dobrą elucję kandydata na szczepionkę przeciw wściekliźnie uzyskano za pomocą adsorbera membranowego Natrix® HD-Q w trybie wiązania i elucji podczas ładowania w buforze na bazie fosforanów (rysunek 4 i 5). Dzięki membranie byliśmy w stanie osiągnąć DBC na poziomie 6, 85% redukcję białka komórki gospodarza wraz z zadowalającym 76% odzyskiem wirusa. DBC zostało zdefiniowane jako obciążenie, przy którym A280 z przełomu przekroczyło A280 zaobserwowane wcześnie podczas ładowania (tj. A280 z przepływu) o 10% różnicy między A280 załadowanej próbki a A280 z przepływu.
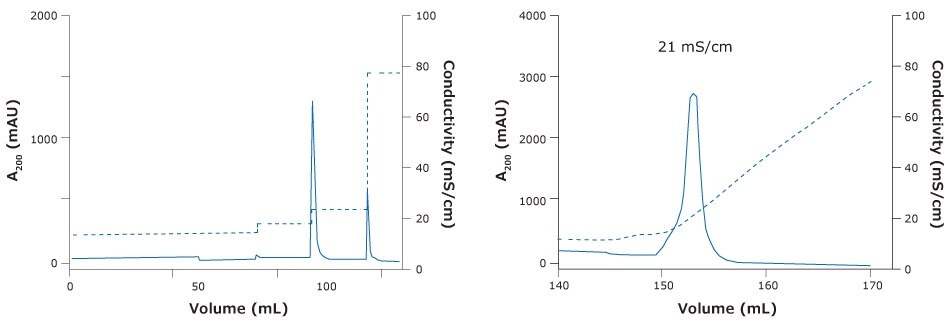
Figure 4.Chromatography of ChAdOx-2-RabG vaccine using Natrix® HD-Q membrane adsorber. (Left) Step elution of ChAdOx2-RabG with NatrixHD Q membrane adsorber. (Right) Gradient elution ChAdOx2-RabG elution peak at 21 mS/cm.
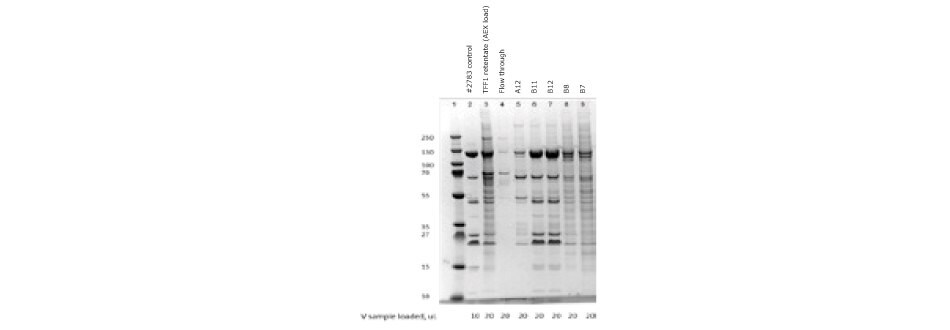
Figure 5.SDS-PAGE of ChAdOx-2-RabG vaccine after anion exchange chromatography. Elution peak samples were loaded in lines B11 and B12.
Jednorazowa ścieżka przepływu
Kolejnym celem pracy było oparcie się na technologiach jednorazowego użytku w rozwoju platformy produkcyjnej. Kontrola pH i DO może być osiągnięta w jednorazowych bioreaktorach Mobius® 3 L przy użyciu dostępnych na rynku inwazyjnych sond jednorazowego użytku. Proces upstream może być skalowany do 2000 L Bioreaktor jednorazowego użytku Mobius®, który zawiera worek jednorazowego użytku z zewnętrzną pętlą przeznaczoną do pobierania próbek za pomocą sond wielorazowych lub jednorazowych. Zestawy do klaryfikacji i TFF zostały zaprojektowane w celu zapewnienia zamkniętego procesu.
Podsumowanie wyników
Współpraca z Jenner Institute zaowocowała stworzeniem jednorazowego, skalowalnego szablonu GMP do produkcji szczepionek opartych na adenowirusach. Nowe podejście skraca czas wymagany do wytworzenia dawek do dwóch dni w przypadku operacji poprzedzających oraz klarowania i trawienia DNA, a następnie trzech dni w przypadku oczyszczania, które opiera się wyłącznie na filtracji.
Nowy proces to pełna ścieżka przepływu jednorazowego użytku, w tym bioreaktory, rurki i wkładki, worki zbiorcze, filtry i membrany chromatograficzne. Osiągnęliśmy nasze początkowe cele polegające na wyprodukowaniu co najmniej 2000 dawek z kultury o pojemności 4 litrów z niezbędnym usuwaniem białek komórek gospodarza i odzyskiwaniem wirusów. Proces ten można skalować do 2000 litrów, wykorzystując różne technologie jednorazowego użytku, takie jak worki bioreaktorów i systemy mieszania do przechowywania mediów i buforów oraz pośredniego mieszania i przechowywania.
Ta udana współpraca jest przykładem tego, jak organizacje publiczne i prywatne mogą współpracować w celu rozwiązania wyzwań stojących przed naszą branżą i dostarczenia znaczących rozwiązań z korzyścią dla globalnej populacji. Dzięki temu szybszemu i bardziej opłacalnemu podejściu do produkcji szczepionek robimy ważny krok w kierunku rozszerzenia dostępu, rozwiązania problemu niedoborów w dostawach i przyspieszenia naszej reakcji na wybuchy epidemii i pandemie.
Podsumowanie
Wektory wirusowe są nośnikami, które dostarczają ładunek genetyczny do komórek docelowych. Poczyniono postępy w projektowaniu wektorów, aby zapewnić bezpieczeństwo tego typu szczepionek. W porównaniu do konwencjonalnych szczepionek, szczepionki oparte na wektorach adenowirusowych mogą wyrażać szeroki zakres antygenów pochodzących od wirusów, bakterii lub pierwotniaków. Wywołują one długotrwałą odpowiedź immunologiczną przeciwko chorobom zakaźnym.
Znajdź więcej zasobów dotyczących produkcji szczepionek wektorowych
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?