Opracowywanie i produkcja atenuowanych szczepionek wirusowych
- How Viruses Become Attenuated
- Produkcja szczepionek wirusowych opartych na komórkach
- Rozmnażanie atenuowanych wirusów w oparciu o komórki
- Objaśnienie atenuowanych wirusów
- Obróbka nukleazą
- Chromatografia.
- Filtracja sterylna, formulacja i wykończenie atenuowanych szczepionek wirusowych
- Powiązane produkty
- Referencje
Atenuowane szczepionki wirusowe są tworzone przy użyciu wirusów o zmniejszonej zjadliwości. Zapewniają one szybką odporność, aktywują wszystkie fazy układu odpornościowego i zapewniają trwałą, długoterminową odporność.
How Viruses Become Attenuated
Wirusy są zazwyczaj atenuowane poprzez pasaż w niespokrewnionych lub obcych gospodarzach, takich jak hodowla tkankowa, zarodkach jaj lub żywych zwierzętach. Podczas pasażowania powstające mutacje mogą umożliwić wirusowi zainfekowanie nowego gospodarza. Poprzez serię pasażowania, wirus może nabyć mutacje, które czynią go mniej zjadliwym w pierwotnym gospodarzu. Jako alternatywę dla mutacji poprzez pasaż, atenuowane wirusy mogą być tworzone przy użyciu inżynierii genetycznej w celu precyzyjnego wprowadzenia mutacji, delecji genów lub substytucji.
Istnieją jednak pewne wady stosowania atenuowanych szczepionek. Wtórna mutacja w atenuowanym wirusie może spowodować powrót do zjadliwości. Oznacza to, że szczepionka może wywołać chorobę u pacjentów z obniżoną odpornością (na przykład chorych na AIDS). Ponadto mogą być trudne w transporcie, ponieważ muszą być utrzymywane w określonych warunkach, takich jak niska temperatura, aby zagwarantować przetrwanie wirusa.
Cell-based Viral Vaccine Manufacturing
Żywe atenuowane szczepionki wirusowe mogą być tworzone przy użyciu złożonego, wieloetapowego procesu produkcyjnego opartego na komórkach. Nie jest to proces szablonowy. Proces produkcji każdej szczepionki wirusowej jest inny i jest podyktowany kształtem, rozmiarem, zachowaniem fizykochemicznym, stabilnością i specyficznością gospodarza. Chociaż różni producenci stosują różne przepływy procesu, ogólny zarys procesu podsumowano na rysunku 1. Ważnym wyzwaniem produkcyjnym przy opracowywaniu atenuowanych szczepionek wirusowych jest to, że wirus musi być żywy i utrzymywać swój potencjał zakaźny przez cały proces przetwarzania i formułowania, aż do momentu podania go zdrowym osobom.
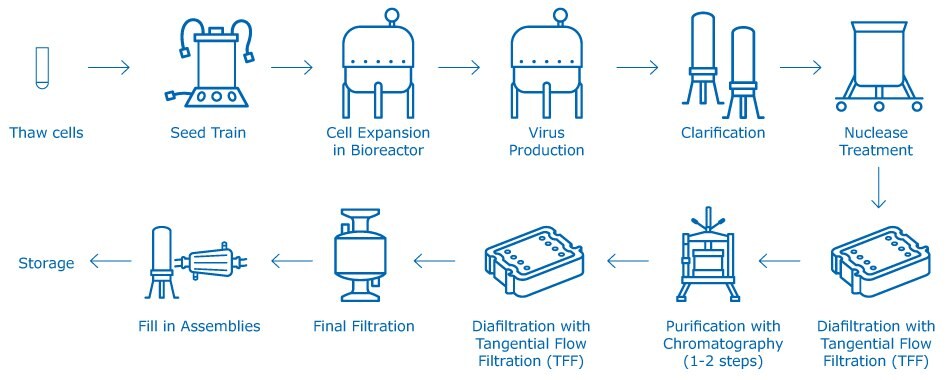
Rysunek 1.Proces produkcji generycznych atenuowanych szczepionek wirusowych.
Cell-based Propagation of Attenuated Viruses
Wirusy są rozmnażane w kulturach komórkowych, hodowanych w butelkach rolkowych (jako jednowarstwowe) lub w kulturach zawiesinowych, lub związanych z mikronośnikami. Typowa objętość partii w butelkach rolkowych wynosi 500-700 l, a hodowla zawiesinowa 1000-2000 l.
Istnieje kilka rodzajów komórek wykorzystywanych do hodowli wirusów do zastosowań w szczepionkach:
- Vero
- Per.C6
- MDCK
- MRC 5
- WI38
Komórki Vero (opracowane z komórek nerki afrykańskiej małpy zielonej) są najczęściej wykorzystywane do produkcji szczepionek wirusowych. Większość kultur komórkowych do zastosowań w szczepionkach wirusowych jest hodowana w niskim napięciu tlenowym w obecności ~5% CO2. Hodowla komórkowa jest prowadzona przez pięć do siedmiu dni przed inokulacją wirusem. Zbiór wirusów następuje po 24 do 72 godzinach od inokulacji. W zależności od typu wirusa, albo wydzielają się one z komórek, albo ulegają lizie i pojawiają się w pozakomórkowym płynie hodowlanym. W niektórych przypadkach komórki muszą zostać poddane lizie poprzez dodanie detergentów lub środków powierzchniowo czynnych (na przykład niejonowego detergentu Tween® 20) w celu uwolnienia wirusów.
Klarowanie atenuowanych wirusów
Klarowanie usuwa komórki lub szczątki komórkowe i zbiera wirusy. Wirowanie strefowe jest powszechnie stosowane do pierwotnego klarowania. Niektórzy producenci stosują również filtrację ze stycznym przepływem (TFF) w warunkach niskiego ścinania lub filtrację z normalnym przepływem (NFF), w większości przypadków filtrację wgłębną, do klarowania szczepionki wirusowej.
Atenuowane wirusy są delikatne i wrażliwe na ścinanie. Preferowane są urządzenia do mikrofiltracji (MF) TFF (bez sita), aby zminimalizować ścinanie. Zawartość substancji stałych w zbiorach szczepionek wirusowych jest niska, więc filtry o normalnym przepływie również dobrze sprawdzają się w takich zastosowaniach. Niektóre atenuowane żywe wirusy mają tendencję do wiązania się z powierzchniami komórek lub zostają uwięzione w lizowanych szczątkach komórkowych. Prowadzi to do ich usunięcia podczas klarowania, co skutkuje słabym odzyskiwaniem wirusów. Ponieważ wirusy są naładowane ujemnie, ważne jest, aby zdawać sobie sprawę z efektów adsorpcyjnych na mediach filtracyjnych.
Nuclease Treatment
Kwasy nukleinowe są ujemnie naładowanymi dużymi składnikami molekularnymi, które zakłócają oczyszczanie wirusów. Przenoszony kwas nukleinowy z lizowanych komórek jest kluczowym zanieczyszczeniem w procesach szczepionek wirusowych. Wirusy rozmnażane w ludzkich komórkach diploidalnych lub komórkach innych niż ludzkie (na przykład wirusy hodowane w liniach komórkowych nerki psa [MDCK]) stwarzają większe ryzyko przeniesienia kwasu nukleinowego. Przepisy wymagają, aby zawartość kwasu nukleinowego w komórkach gospodarza nie przekraczała 10 ng/dawkę atenuowanej szczepionki wirusowej.
Benzonase® endonuclease jest powszechnie stosowana do degradują kwasy nukleinowe, takie jak RNA i DNA komórek gospodarza do zaledwie trzech do ośmiu par zasad (<6 kDa). Zbiór wirusów jest poddawany działaniu ~0,9 do ~1,1 jednostek/ml endonukleazy Benzonase® w temperaturze 30-34 °C przez cztery do ośmiu godzin. Po obróbce endonukleazą Benzonase® zbiór jest diafiltrowany przy użyciu TFF (urządzenia do ultrafiltracji 100-300 kDa) działającego przy niskim przepływie krzyżowym w celu usunięcia endonukleazy Benzonase® i zdegradowanych składników kwasu nukleinowego. Typowy strumień (dla membrany ultrafiltracyjnej 300 kDa Biomax®) wynosi 25 LMH przy ciśnieniu transmembranowym (TMP) 1,5-3,0 psi i natężeniu przepływu 4-5 l/min/m².
Chromatography
Benzonase® endonuclease. jest wystarczająca, aby doprowadzić większość atenuowanych szczepionek wirusowych - między innymi przeciw odrze, śwince, różyczce, polio, rotawirusowi i żółtej febrze - do pożądanego poziomu czystości podczas etapu zatężania i diafiltracji. Chromatografia jest jednak zwykle wymagana do doprowadzenia szczepionek wirusowych nowej generacji, takich jak wirus japońskiego zapalenia mózgu (JEV) i wirus dengi (DENV), do pożądanego poziomu czystości. Na przykład, ester siarczanowy kowalencyjnie połączony z matrycą celulozową może być stosowany do oczyszczania JEV. Wirus wiąże się z matrycą w oparciu o interakcję w trybie mieszanym z receptorami powierzchniowymi wirusa lub domeną wiążącą heparynę obecną na kilku wirusach otoczkowych. Ponieważ wirusy są naładowane ujemnie, chromatografia anionowymienna (Q lub DEAE) działa dobrze w trybie wiązania i elucji lub w trybie przepływu. Operacje te przebiegają w łagodnych warunkach z niską zawartością soli.
Po chromatografii eluowany wirus jest zatężany przy użyciu urządzeń TFF o masie 100-300 kDa. Czystość żywych szczepionek wirusowych jest określana poprzez pomiar usuniętych zanieczyszczeń (albumina surowicy bydlęcej, albumina jaja kurzego, resztkowe DNA, białko komórki gospodarza itp.) Jakość i ilość wirusa w oczyszczonej masie jest określana przez oszacowanie stężenia wirusa na podstawie miana HA, przeciwciał neutralizujących i testu zakaźności CCID50.
Sterile Filtration, Formulation, and Fill Finish of Attenuated Viral Vaccines
Final virus vaccine bulk is comparable to that of water. Podczas końcowej filtracji szczepionka jest sterylizowana za pomocą filtra sterylizującego 0,22 µm.
Sformułowanie atenuowanych szczepionek wirusowych wymaga szczególnej uwagi:
Wielowalentność
Wiele atenuowanych szczepionek wirusowych zawiera różne szczepy. Te wielowartościowe szczepionki obejmują rotawirusy, polio i dengę. Są one aseptycznie mieszane po sterylnej filtracji.
Adiuwanty
Większość żywych atenuowanych szczepionek wirusowych nie wymaga żadnych adiuwantów, ponieważ są one naturalnie silnymi immunogenami. Większość z nich, na przykład odra, świnka i różyczka, jest liofilizowana (liofilizowana).
Substancje pomocnicze
Końcowa formulacja atenuowanych szczepionek wirusowych zawiera niewielką ilość antybiotyków (neomycyna), substancji pomocniczych (albumina surowicy ludzkiej, HAS), stabilizatora (hydrolizowana żelatyna, białko jaja, sorbitol, sacharoza) i środków buforujących (NaCl, inne sole). Większość z tych szczepionek jest podawana podskórnie, z wyjątkiem szczepionek przeciwko rotawirusom i wirusowi polio, które są izotonicznymi roztworami podawanymi doustnie.
Znajdź więcej zasobów na temat produkcji szczepionek na bazie komórek
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?