Fabricação de vacinas de vetores virais
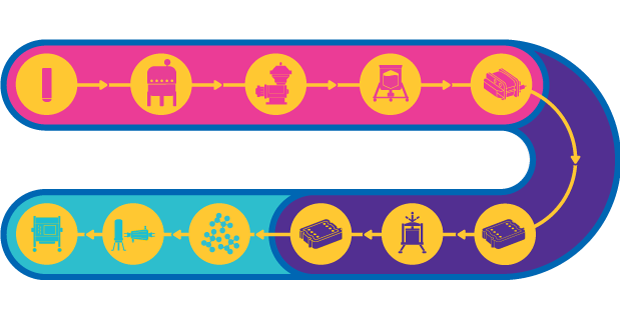
Fig. 1.Etapas do processo para vacinas de vetores virais
Uma vacina de vetor viral vivo usa um microrganismo atenuado ou inofensivo como um adenovírus para transportar porções de um antígeno para estimular uma resposta imunológica. Vacinas vetorizadas são capazes de induzir uma imunidade potente mediada por células, que é essencial para doenças complexas como AIDS, malária e câncer, entre outras.
Embora o processo de fabricação para vetores de vacinas seja razoavelmente modelado, podem surgir alguns desafios, uma vez que diversos vírus diferentes com propriedades variáveis podem ser utilizados. Para vetores virais grandes, a esterilidade do processo é essencial devido à perda de rendimento associada à filtração estéril. Também existem desafios relacionados à agregação e estabilidade dos vetores.
Além disso, muitos processos de fase I/II envolvem culturas celulares aderentes e, como resultado, o escalonamento para a fase III e fabricação comercial pode requerer ajustes no processo para atingir as metas de produção. Em fases posteriores, o rendimento e a pureza do produto são fundamentais, uma vez que são necessários títulos de alta dose no produto final.
Recursos relacionados
Bioprocessamento
Biopharmaceutical Applications Guide - Vaccines
Brochura: Vaccine Bioprocessing Handbook
Minimanual: Viral Vector Vaccine Bioprocessing
Webinar: Process Development Guidance for AAV and Lentivirus Manufacturing Based on Cost Modeling
Webinar: Sf-RVN Cell Line & CD Media Platform, A Production Platform for VLP and AAV
Informe técnico: Developing an Accelerated and More Cost-Effective Single-Use Adenoviral Vector Vaccine Manufacturing Process
Redução de DNA
Purificação e clarificação
Artigo técnico: Purification or Removal of Viruses including Adeno-associated Virus
Artigo: Robust Harvest Clarification For Adeno-Associated Viral Vectors Via Depth Filtration
Artigo: Clarification of vaccines: An overview of filter based technology trends and best practices
Artigo: Filter-Based Clarification of Viral Vaccines and Vectors Biosafety
Artigo: How to Ensure Biosafety Of Novel Viral Therapies
Acelere o tempo até a fase clínica e, ao mesmo tempo, garanta um escalonamento confiável
Os processos de cultura upstream desenvolvidos para a fabricação de vacinas de vetores virais devem ser otimizados para atender aos requisitos de produtividade. Essa otimização inclui etapas de lise e clarificação celulares que são essenciais para a remoção de células e detritos celulares e para garantir uma coleta robusta de vetores. No entanto, o processo upstream é bem-sucedido apenas se puder ser escalonado de forma confiável para atender à demanda esperada do mercado.
Atinja metas de rendimento e eficiência com remoção robusta de impurezas
Ácidos nucleicos de células lisadas são um contaminante comum em processos de vacinas de vetores virais. Os regulamentos exigem que o nível de ácidos nucleicos residuais das células hospedeiras fique abaixo de 10 ng/dose de vacina viral atenuada. O tratamento com a endonuclease Benzonase® seguido por filtração de fluxo tangencial é uma combinação robusta e poderosa para degradar e remover componentes de ácidos nucleicos residuais.
Maximize a recuperação downstream
Lotes clínicos em pequena escala são tipicamente purificados com o uso de ultracentrifugação por gradiente de densidade à base de CsCl, enquanto a produção em larga escala requer um processo de cromatografia de duas ou três etapas. A troca aniônica normalmente é usada para remover HCP (do inglês, proteínas de células hospedeiras), DNA, RNA e outros contaminantes importantes, enquanto a cromatografia de exclusão por tamanho é usada para a remoção de contaminantes em níveis de traço.
Garanta a segurança de pacientes
A filtração estéril garante a esterilidade do produto formulado final e a segurança de pacientes. Um tamanho de poro de filtro de 0,22 µm ou menos é necessário para eliminar os contaminantes microbianos. O nível de agregados virais é uma consideração importante no processo de filtração estéril. Esses agregados precisam ser controlados com a otimização da formulação, caso contrário, o processo de filtração estéril será desafiador com potencial para altas perdas no rendimento.
Tratamento e clarificação com nuclease
Garanta uma escalabilidade robusta.
- • Nuclease treatment with Benzonase® suitable for biopharmaceutical production EMPROVE® bio
- • Benzonase® Detection with Benzonase® Elisa Kit II to detect left over Benzonase® endonuclease in the process
- • Primary/Secondary Clarification with Millistak+® HC POD Depth Filters
- • Primary Clarification with Clarisolve® Depth Filters
- • Clarification Depth Filters & Pretreatment Solutions

Filtração de fluxo tangencial downstream
Atinja metas de rendimento, eficiência e recuperação de pDNA garantindo a remoção robusta de impurezas
Cromatografia downstream
- • Membrane Chromatography with Natrix® Q Pilot Chromatography Membranes
- • Membrane Chromatography with Natrix® Q Recon Mini
- • Membrane Chromatography with Eshmuno® Q Resin
- • Affinity Chromatography with Fractogel® EMD DEAE Chromatography Resins
- • Affinity Chromatography with Fractogel® EMD DMAE Chromatography Resins

Reagentes químicos e formulação do processo downstream

Meios e tampões líquidos de cultura celular para bioprocessamento
Oferecemos os recursos de líquidos filtrados estéreis de mais alta qualidade do setor, fornecendo produtos para meios de cultura celular, tampões, CIP e SIP prontos para uso, provenientes de instalações em conformidade com as BPF em todo o mundo para otimizar sua produção de biofarmacêuticos.
Filtração e envase finais estéreis
Garanta a segurança de pacientes com um processo de filtração estéril confiável e robusto.
· Filtração e envase finais estéreis
· Estratégias para filtração estéril
· Amostragem estéril com as soluções de amostragem estéril Novaseptum® Go
· Envase com as soluções de envase de uso único Mobius®

Para continuar lendo, faça login ou crie uma conta.
Ainda não tem uma conta?



