Fabricação de vacinas à base de vírus
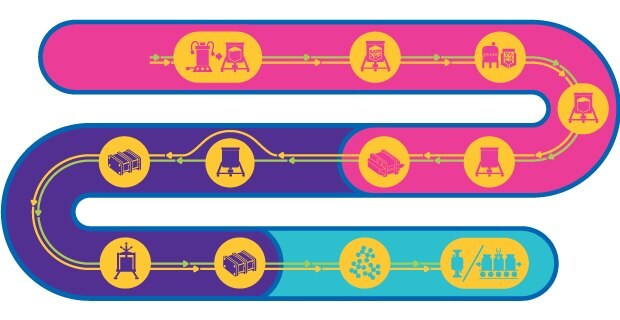
Etapas do processo para vírus inativados e atenuados vivos
As vacinas à base de vírus consistem no vírus atenuado ou inativado. Essas vacinas podem ativar todas as fases do sistema imunológico e oferecem imunidade rápida e duradoura em longo prazo por meio da geração de anticorpos neutralizantes contra o patógeno-alvo.
O processo para fabricar vacinas à base de vírus atenuado é complexo, consiste em diversas etapas e deve manter o potencial infeccioso do vírus atenuado. Embora exista um fluxo de trabalho geral para a produção, não há uma abordagem modelada para a fabricação. Alternativamente, cada processo deve ser adaptado à forma, tamanho, natureza, comportamento físico-químico, estabilidade e especificidade ao hospedeiro do vírus.
Recursos relacionados
Biopharmaceutical Applications Guide
Brochura: Vaccine Bioprocessing Handbook
Minimanual: Cell-Based Vaccine Bioprocessing
Brochura: Enabling Solutions for Vaccines and Viral Therapies
Informe técnico: Filtration Strategies for Optimal Development and Purification of a Foot and Mouth Disease Virus
Informe técnico: Downstream Process Intensification for Virus Purification Using Membrane Chromatography
Nota de aplicação: Effect of Benzonase® Endonuclease Addition to Purification of Sabin Polio Virus Type 3
Artigo técnico: Choosing the Optimal Cell Culture Media for Vaccine Production
Artigo técnico: Choosing the Optimal Vaccine Adjuvant
Artigo: Nucleic Acid Impurity Reduction in Viral Vaccine Manufacturing
Artigo: Filter-Based Clarification of Viral Vaccines and Vectors
Otimize a produtividade e clarificação a montante (upstream) com escalonamento confiável
Os processos de cultura a montante (upstream) desenvolvidos para a fabricação de vacinas à base de vírus devem ser otimizados para atender aos requisitos de produtividade. Essa otimização inclui a etapa de clarificação, que é essencial para a remoção de células e detritos celulares, e para garantir uma coleta robusta de vírus. No entanto, o processo a montante (upstream) é bem-sucedido apenas se puder ser escalonado de forma confiável para atender à demanda esperada do mercado.
Atinja metas de rendimento e eficiência com remoção robusta de impurezas
Ácidos nucleicos de células lisadas são um contaminante comum em processos de vacinas à base de vírus. Os regulamentos exigem que o nível de ácidos nucleicos residuais das células hospedeiras fique abaixo de 10 ng/dose de vacina à base de vírus atenuado. O tratamento com a endonuclease Benzonase® seguido por filtração de fluxo tangencial é uma combinação robusta e poderosa para degradar e, em seguida, remover componentes de ácidos nucleicos residuais.
Maximize a recuperação a jusante (downstream)
O tratamento com a endonuclease Benzonase® é suficiente para atingir o nível desejado de pureza para a maioria das vacinas à base de vírus durante a concentração e diafiltração. No entanto, a cromatografia é necessária para atingir as metas de pureza para vacinas à base de vírus de próxima geração, como o vírus da encefalite japonesa (JEV) e vírus da dengue (DENV). Uma vez que cada processo de fabricação deve ser adaptado às características do vírus, um conjunto de ferramentas de opções para purificação a jusante (downstream) é essencial para propiciar a pureza desejada enquanto se garante uma recuperação ideal.
Garanta a segurança de pacientes
Embora vacinas à base de vírus sejam fabricadas com o uso de vírus atenuados, garantir a segurança dos pacientes permanece uma preocupação importante. O concentrado da vacina viral final é comparável ao da água. Dessa forma, a vacina pode ser esterilizada com o uso de filtro esterilizante de 0,22 µm antes das etapas de formulação final e envase-acabamento.
Fluxo de trabalho
Tratamento e clarificação com nuclease
Garanta uma escalonabilidade robusta
- Nuclease treatment with Benzonase® suitable for biopharmaceutical production EMPROVE® bio
- Benzonase® Detection with Benzonase® Elisa Kit II to detect left over Benzonase® endonuclease in the process
- Primary/Secondary Clarification with Millistak+® HC POD Depth Filters
- Primary Clarification with Clarisolve® Depth Filters
- Secondary Clarification with Polysep II cartridges

Meios e tampões líquidos para cultura celular para bioprocessamento
Oferecemos os recursos de líquidos filtrados estéreis de mais alta qualidade do setor, fornecendo produtos para meios de cultura celular, tampões, CIP e SIP prontos para uso, provenientes de instalações em conformidade com as BPF em todo o mundo para otimizar sua produção de biofarmacêuticos.

Filtração de fluxo tangencial a jusante (downstream)
Atinja metas de rendimento, eficiência e recuperação de vírus enquanto garante a remoção robusta de impurezas
Cromatografia a jusante (downstream)
- Membrane Chromatography with Eshmuno® Q Resin
- Membrane Chromatography with Natrix® Q Recon Mini Chromatography Membranes
- Membrane Chromatography with Natrix® Q Pilot Chromatography Membrane
- Capture an/or Polishing Chromatography with Fractogel® EMD DEAE Chromatography Resins
- Capture an/or Polishing Chromatography with Fractogel® EMD DMAE Chromatography Resins

Produtos químicos e formulação para processos
Filtração e envase finais estéreis
Elimine preocupações com contaminação cruzada de produtos e, simultaneamente, agilize os requisitos de envase-acabamento e cumpra os requisitos regulatórios atuais

Para continuar lendo, faça login ou crie uma conta.
Ainda não tem uma conta?


