Kulki magnetyczne Anti-FLAG® M2
- Anti-FLAG® Kulki magnetyczne M2 do wychwytywania białek FLAG® Tag Protein Capture
- Przygotowanie próbki i oczyszczanie metodą powinowactwa
- Elektroforeza i Western Blotting
- Porównanie technik elucji dla białek fuzyjnych znakowanych FLAG
- Anti-FLAG® M2 Magnetic Beads for FLAG® Tag Protein Capture
Kulki magnetyczne Anti-FLAG® Kulki magnetyczne M2 zapewniają łatwą, szybką i wygodną metodę wykrywania i wychwytywania białek fuzyjnych z sekwencją peptydową FLAG® . Kulki składają się z mysiego przeciwciała monoklonalnego anty-FLAG® klonu M2 przyłączonego do superparamagnetycznych kulek agarozowych impregnowanych 4% żelazem. Przeciwciało anty-FLAG® M2 rozpoznaje sekwencję oktapeptydową FLAG® (N-Asp-Tyr-Lys-Asp-Asp-Asp-Lys-C) na N-końcu, Met-N-końcu lub C-końcu białka fuzyjnego wyrażanego w komórkach ssaków i bakterii.
Istnieją różne opcje elucji białka fuzyjnego przy użyciu kulek magnetycznych anty-FLAG® M2, które obejmują konkurencję peptydową, niskie pH i bufor do próbek SDS-PAGE. Tutaj porównaliśmy trzy metody elucji dla kontrolnego białka fuzyjnego N-końcowego Met-3XFLAG®-BAP (P7582) lub C-końcowy FLAG®-BAP (P7457) inkubowane samodzielnie lub dodawane do lizatu komórek A431.
Elucja przez konkurencję z 3X FLAG® peptydem (F4799), jak również kwaśne pH (2.5-3,0) zapewniły najbardziej wydajne warunki elucji dla kulek magnetycznych Anti-FLAG® M2. W przypadku elucji peptydem 3X FLAG® próbki wymagały 30-minutowej inkubacji z roztworem 100-150 ng/µL peptydu FLAG, podczas gdy w przypadku elucji pH próbki wymagały mniej niż 10-minutowej inkubacji z 0,1 M glicyny HCl pH 2,5-3,0. Wykazaliśmy również, że elucja przez wysokie pH (8-10) nie była wystarczająca w przypadku tego typu kulek, a przedłużone inkubacje z glicyną HCl nie zwiększają ilości eluowanego białka. Na koniec porównaliśmy również próbki eluowane przy użyciu buforu do próbek SDS-PAGE. Ten warunek elucji był prosty, ale ponieważ przeciwciało M2 jest denaturowane przez obecność SDS w buforze obciążającym, analiza za pomocą elektroforezy żelowej wykazała pasma odpowiadające ciężkim i lekkim łańcuchom przeciwciała anty-FLAG® .
Przygotowanie próbki i oczyszczanie metodą powinowactwa
Kulki magnetyczne Anti-FLAG® Kulki magnetyczne M2 (M8823) zostały dokładnie zawieszone, a 20 µL zawiesiny (w tym 10 µL zapakowanej żywicy) podzielono na kilka probówek mikrowirówkowych o pojemności 1,5 ml.5 ml probówek do mikrowirówki. Probówki umieszczono w statywie magnetycznym PureProteome™ (LSKMAGS08), a supernatant usunięto i wyrzucono po migracji wszystkich kulek do magnesu. Żywicę wyrównano przez dodanie 200 µL soli fizjologicznej buforu Tris (TBS), a następnie inkubację próbki (Rysunek 1).
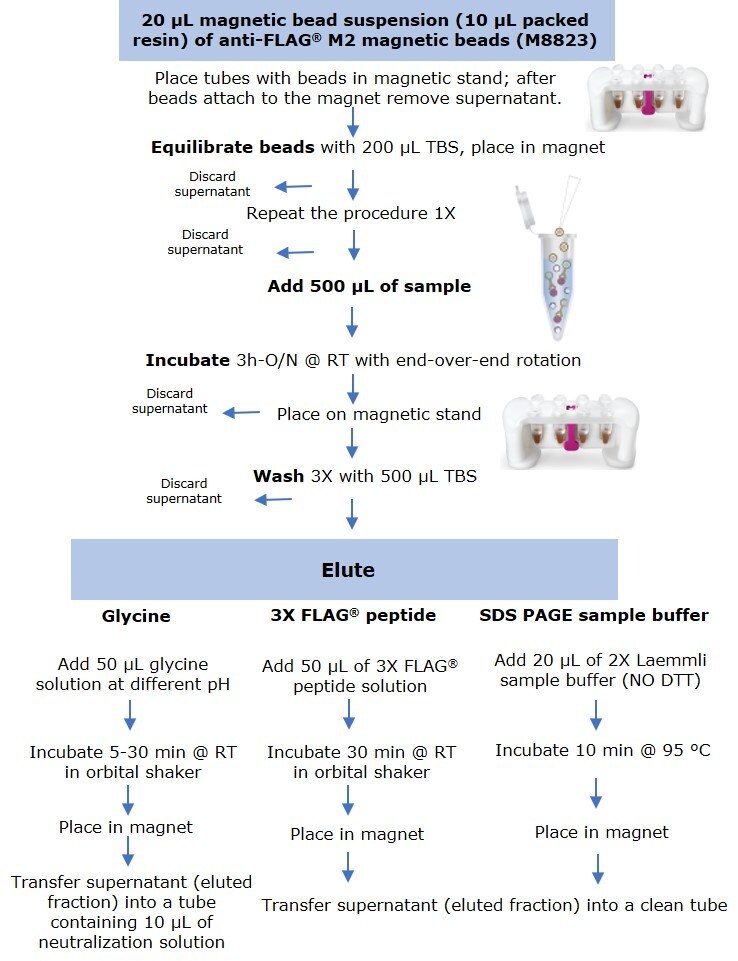
Rysunek 1.Protokół do immunoprecypitacji na małą skalę za pomocą kulek magnetycznych anty-FLAG® M2 przy użyciu trzech metod elucji.
Próbki przygotowano przez rozcieńczenie C-końcowego białka fuzyjnego FLAG-BAP™ lub N-końcowego białka fuzyjnego FLAG-BAP™ do końcowego stężenia 0,6 ng/µl (300 ng białka w 500 µl próbki). Białko fuzyjne FLAG-BAP™ wprowadzono również w tym samym stężeniu końcowym do lizatu komórek A431 rozcieńczonego do całkowitego stężenia lizatu białka 1,6 ng/µl. Aby utrzymać kulki w zawiesinie i w kontakcie z 500 µL próbki, probówki inkubowano przez 3 godziny do nocy przy użyciu rotora typu end-over end. Po inkubacji wszystkie probówki umieszczono w statywie magnetycznym i usunięto supernatant, a następnie trzykrotnie przepłukano 500 µL TBS. Białko eluowano trzema metodami:
- Elucję przez konkurencję przy użyciu peptydu 3X FLAG® przeprowadzono w temperaturze pokojowej przez inkubację kulek przez 30 minut z 50 µL roztworu peptydu 100 ng/µL przy użyciu wytrząsarki orbitalnej.
- Dla próbek eluowanych buforem do próbek SDS-PAGE, dodano 20 µL 2X buforu do próbek Laemmli (bez DTT), a probówki gotowano przez 10 minut w temperaturze 95°C, przed załadowaniem na żel.
- Elucję według pH przeprowadzono w temperaturze pokojowej, inkubując kulki przez 5 do 30 minut (w zależności od eksperymentu) z 50 µL glicyny HCl (pH 2,5-3,0) lub glicyny NaOH (pH 8.0 - 10) przy użyciu wytrząsarki orbitalnej.
Po inkubacji wszystkie probówki umieszczono w stojaku magnetycznym, a supernatant (frakcję eluowaną) przeniesiono do czystej probówki do mikrowirówki. Próbki eluowane z niskim pH były natychmiast neutralizowane przez dodanie 10 µL 0,5 M roztworu Tris, 1,5 M NaCl pH 8,0.
Elektroforeza i Western Blotting
Próbki zostały rozdzielone przy użyciu 4-12% żeli SDS-PAGE, prowadzonych przez 30 minut przy 200 woltach. Żele barwiono Coomassie lub przenoszono na membranę Immobilon®-P PVDF. Po przeniesieniu, bloty blokowano 2% beztłuszczowym suchym mlekiem (NFDM) przez 1 godzinę, a następnie przez 1 godzinę inkubowano z przeciwciałem anty-FLAG® M2 (F3165) rozcieńczonym 1:1000 w buforze blokującym. Bloty płukano trzykrotnie w TBS-T i inkubowano przez 1 godzinę z kozim anty-mysim IgG HRP (AP124P) rozcieńczonym 1:50 000.
W celu detekcji wszystkie bloty inkubowano przez 5 minut z substratem Immobilon® Forte Western HRP, a obraz uzyskano za pomocą cyfrowego systemu obrazowania.
Porównanie technik elucji dla białek fuzyjnych znakowanych FLAG
Dwa kontrolne białka fuzyjne, N-końcowe FLAG-BAP™ i C-końcowe FLAG-BAP™, jak również lizat komórek A431 z dodatkiem N-końcowego FLAG-BAP™, inkubowano z kulkami magnetycznymi anty-FLAG® M2 i eluowano przy użyciu trzech różnych metod elucji. Rysunek 2 pokazuje, że białka były skutecznie eluowane przy użyciu wszystkich trzech metod, z dodatkowymi pasmami odpowiadającymi ciężkiemu i lekkiemu łańcuchowi przeciwciała anty-FLAG® M2 widocznymi, gdy jako eluent zastosowano bufor obciążający SDS.
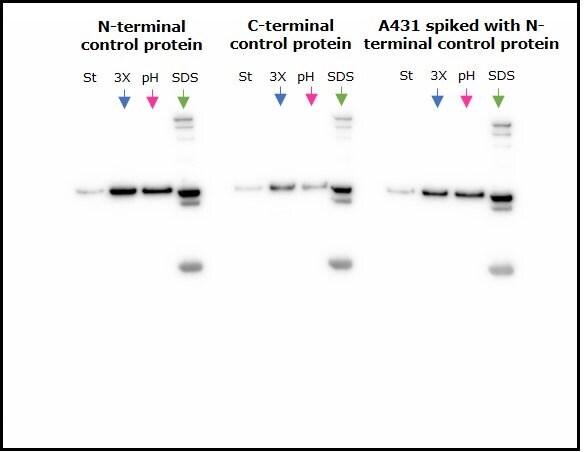
Rysunek 2.Porównanie trzech metod elucji stosowanych z kulkami magnetycznymi M2 anty-FLAG®. St=materiał wyjściowy; 3X=3X peptyd FLAG®, pH=2,5 glicyna
Roztwory glicyny HCl (pH 2,5-3,0) i glicyny NaOH (pH 8-10,6) zastosowano do elucji ośmiu próbek zawierających lizat komórek A431 wzbogacony N-końcowym białkiem kontrolnym FLAG-BAP™. Wymyte frakcje rozdzielono metodą elektroforezy i poddano elektroblottingowi. Wyniki wykazały, że kulki magnetyczne anty-FLAG® M2 mogą być eluowane tylko w warunkach kwaśnych (Rysunek 3).

Rysunek 3.Elucja w szerokim zakresie pH (2,5 do 10,6), w porównaniu z elucją przy użyciu peptydu 3X FLAG®. Po lewej: żel barwiony koomassą. Po prawej: Immunoblot z przeciwciałem anty-FLAG® M2.
Aby wykazać, że elucja przez pH nie wymaga więcej niż 10 minut inkubacji z kulkami, różne próbki poddano różnym czasom inkubacji przy użyciu 0,1 M glicyny HCl o pH 2,5, 2,8 i 3,0. Rysunek 4 pokazuje, że wydajność była porównywalna niezależnie od czasu inkubacji i podobna do elucji przez konkurencję z peptydem 3X-FLAG.
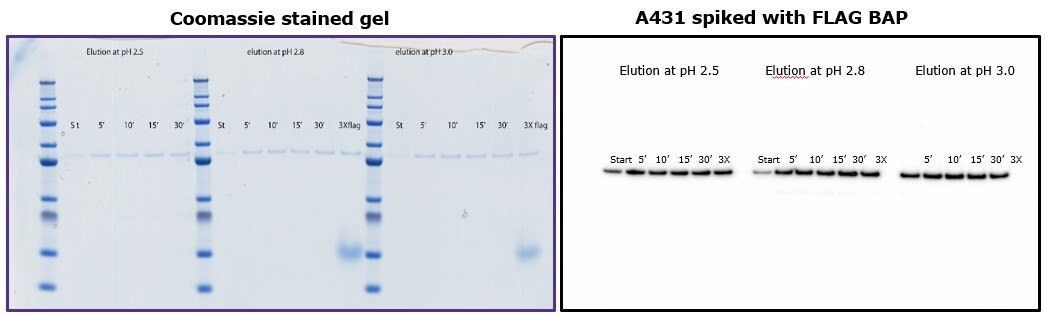
Rysunek 4.Porównanie eluowanych frakcji po inkubacji od 5 do 30 minut z glicyną. Po lewej: żel barwiony koomassą. Po prawej: Immunoblot z przeciwciałem anty-FLAG® M2.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?