Wybór soli i przygotowanie buforu
Sole
W HIC proces wiązania jest bardziej selektywny niż proces elucji, dlatego niezbędna jest optymalizacja warunków buforu startowego. Prawidłowy wybór soli i jej stężenie są najważniejszymi parametrami, które wpływają na wydajność i końcową selektywność. Celem jest optymalizacja warunków, aby osiągnąć wymaganą selektywność wiązania docelowego białka (białek) i zapewnić, że większość zanieczyszczeń przejdzie przez kolumnę.
Wpływ różnych soli na oddziaływanie hydrofobowe wyjaśniono w rozdziale 1. W praktyce siarczany sodu, potasu lub amonu skutecznie promują interakcje ligand-białko w HIC i mają stabilizujący wpływ na strukturę białka. Stąd najczęściej stosowanymi solami są (NH4)2SO4Na2SO4, NaCl, KCl i CH3COONH4. Rysunek 1 pokazuje przykład tego, jak różne sole mogą wpływać na selektywność. Tutaj najlepszą rozdzielczość czterech standardowych białek uzyskano stosując 1,7 M siarczan amonu w buforze startowym.
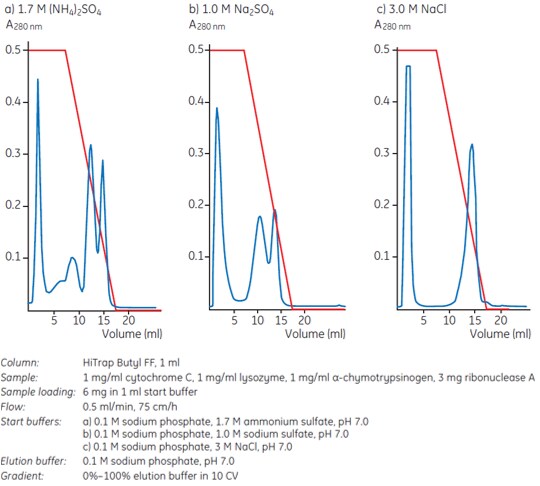
Rysunek 1. Różne sole wpływają na selektywność: elucja odbywa się w kolejności rosnących objętości elucji: cytochrom C, lizozym, rybonukleaza A, α-chymotrypsynogen.
Podobnie jak w przypadku wyboru mediów, wybór soli do separacji HIC może być kwestią prób i błędów, ponieważ każda sól różni się pod względem zdolności do promowania oddziaływań hydrofobowych. Wraz ze wzrostem stężenia soli, ilość związanego białka wzrośnie niemal liniowo do określonego stężenia soli i będzie nadal rosła w sposób wykładniczy przy wyższych stężeniach.
- W danym stężeniu siarczan amonu często zapewnia najlepszą rozdzielczość w porównaniu z innymi solami i może być stosowany w stężeniach do 2 M.
- Stężenia do 3 M są zwykle wymagane przy stosowaniu chlorku sodu.
- Siarczan sodu jest bardzo dobrym środkiem solnym, ale problemy z rozpuszczalnością białek mogą wykluczać jego stosowanie w wysokich stężeniach.
- Siarczan amonu nie jest zalecany do pracy przy wartościach pH powyżej 8,0.
Stężenie soli
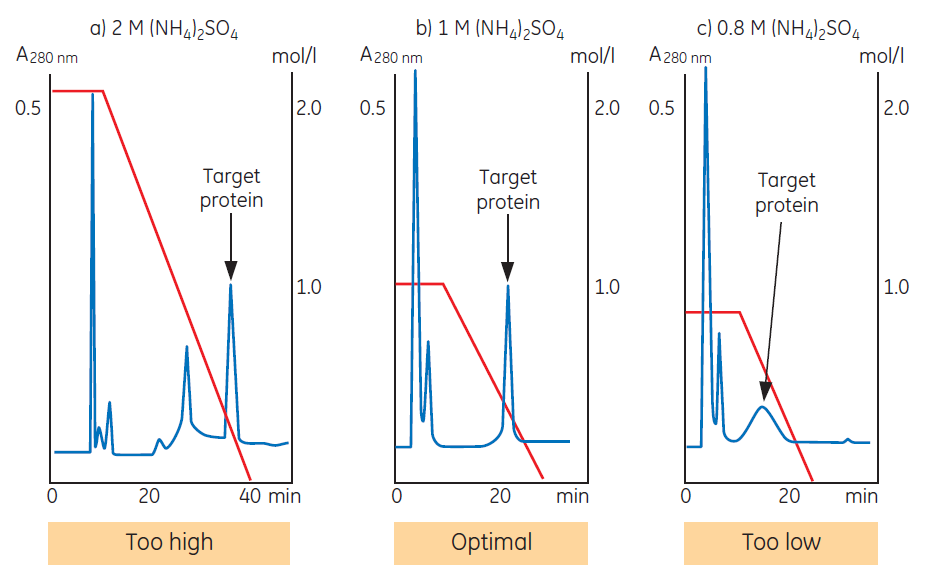
Rysunek 2. Stężenie soli w buforze startowym wpływa na selektywność i rozdzielczość.
Rysunek 2 pokazuje wpływ stężenia soli na selektywność i rozdzielczość. W tym przykładzie docelowe białko jest ostatnim pikiem do elucji. Selektywność medium jest zadowalająca, ponieważ białko eluuje w gradiencie i jest dobrze oddzielone od zanieczyszczeń. W (a) białko docelowe eluuje w ostrej strefie, ale późno w gradiencie. Obniżenie początkowego stężenia soli (b) daje podobną rozdzielczość, ale zapewnia, że zanieczyszczenia, które związały się podczas wcześniejszych przebiegów (gdy użyto wyższego stężenia soli) teraz eluują podczas początkowego etapu płukania. Wiązane jest tylko białko docelowe, co zmniejsza ryzyko koelucji zanieczyszczeń z białkiem docelowym i zwiększa pojemność kolumny dla białka docelowego. Przebieg przeprowadzony przy jeszcze niższym początkowym stężeniu soli (c) wykazuje dobrą selektywność, ale słabą wydajność dla białka docelowego. Próbka nie jest wystarczająco silnie związana podczas aplikacji próbki, co powoduje znaczne poszerzenie piku podczas elucji.
- Jeśli docelowa cząsteczka eluuje zbyt późno lub wcale, a przełączenie na inne medium nie jest możliwe, spróbuj związać w 50% mniej soli.
- Niektóre białka zaczynają się wytrącać przy wysokich poziomach soli. Stężenie soli w buforze startowym może wymagać zmniejszenia, aby zapobiec wytrącaniu podczas przebiegu. Powtarzalne ładowanie próbki w małych ilościach może również pomóc uniknąć utraty wydajności z powodu wytrącania.
Jony buforujące i pH
Wybór jonów buforujących nie jest krytyczny dla oddziaływań hydrofobowych. Najczęściej stosowane są bufory fosforanowe.
Wybrane pH musi być zgodne ze stabilnością i aktywnością białka, dlatego zaleca się sprawdzenie optymalnych warunków pH dla każdego konkretnego zastosowania. Jednak w zakresie pH 5-8,5 wartości pH mają bardzo niewielkie znaczenie dla ostatecznej selektywności i rozdzielczości separacji HIC. Wzrost pH osłabia oddziaływania hydrofobowe, a retencja białek zmienia się bardziej drastycznie przy wartościach pH powyżej 8,5 lub poniżej 5,0.
- Sprawdź stabilność przy pH i stężeniach soli stosowanych podczas separacji, zwłaszcza jeśli priorytetem jest odzyskanie aktywności biologicznej. Unikaj ekstremalnych zmian pH lub innych warunków, które mogą powodować inaktywację lub nawet wytrącanie.
- Używaj stężenia buforu, zwykle 20-50 mM, które jest wystarczające do utrzymania zdolności buforowania i pH podczas stosowania próbki i zmian stężenia soli.
- Przenieść oczyszczone białko do lotnego buforu, jeśli produkt ma być liofilizowany. Tabela 3 zawiera listę odpowiednich lotnych systemów buforowych.
- Przygotuj bufory w tej samej temperaturze, w której będą używane, aby zapewnić prawidłowe pH.
- Filtruj bufory i próbki po dodaniu wszystkich soli i dodatków. Używaj wysokiej jakości wody i chemikaliów. Używaj filtrów 1 μm dla mediów o wielkości cząstek powyżej 90 μm, filtrów 0,45 μm dla cząstek 34 μm i filtrów 0,22 μm dla cząstek poniżej 15 μm lub gdy wymagane są sterylne lub wyjątkowo czyste próbki. Aby uniknąć tworzenia się pęcherzyków powietrza w upakowanej kolumnie i zapewnić powtarzalne wyniki, kolumna i bufory powinny mieć tę samą temperaturę podczas przygotowywania do przebiegu.
- Dla próbek o nieznanych właściwościach hydrofobowych wypróbuj następujące metody:
Bufor startowy: 1,5 M siarczan amonu, 50 mM fosforan sodu, pH 7,0
Bufor elucyjny: 50 mM fosforan sodu, pH 7,0
Dodatki do buforu
Dodatki mogą być stosowane w celu poprawy selektywności i rozdzielczości, na przykład gdy białko wiąże się zbyt silnie z podłożem HIC. Jednakże, jeśli są stosowane w wysokich stężeniach, istnieje ryzyko inaktywacji i/lub denaturacji białka docelowego. Dodatki mogą wpływać na rozdział poprzez poprawę rozpuszczalności białka, modyfikację konformacji białka i promowanie elucji związanych białek. Alkohole mieszające się z wodą, detergenty i sole chaotropowe (ograniczone zastosowanie) są najczęściej stosowanymi dodatkami w separacjach HIC. Typowe dodatki przedstawiono w Tabeli 4.
Uruchom puste gradienty elucji z dodatkami w celu sprawdzenia ich wpływu na profil elucji (tj. wykonaj przebieg, ale nie ładuj żadnej próbki).
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?