Praktyczne rozważania dotyczące separacji IEX
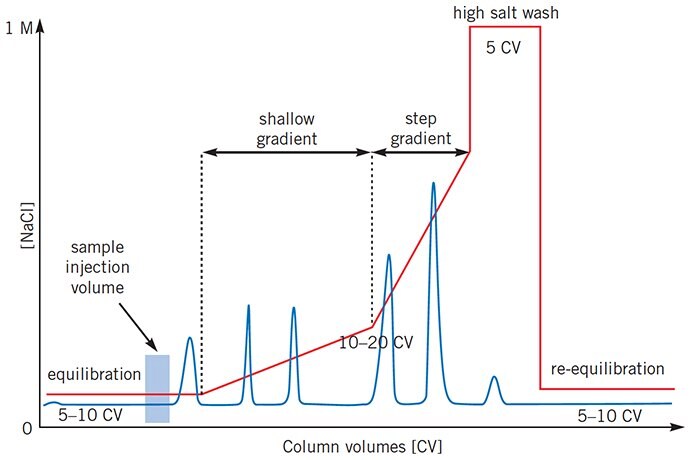
Ta sekcja obejmuje szczegółowe aspekty każdego etapu separacji IEX, wraz z praktycznymi wskazówkami i poradami dotyczącymi poprawy rozdzielczości i ogólnej wydajności. W praktyce separację można podsumować w następujący sposób:
- Kolumnę należy skalibrować za pomocą 5-10 objętości buforu początkowego lub do momentu, gdy wartość wyjściowa, pH eluentu i przewodność będą stabilne.
- Dostosuj próbkę do wybranego początkowego pH i siły jonowej i nałóż na kolumnę.
- Przepłukać kolumnę 5-10 objętościami buforu początkowego lub do momentu, gdy wartość wyjściowa, pH eluentu i przewodność będą stabilne, tj. gdy cały niezwiązany materiał zostanie przepłukany przez kolumnę.
- Rozpocząć elucję przy użyciu gradientu o objętości 10-20 objętości kolumny o rosnącej sile jonowej do 0,5 M NaCl (50%B). Alternatywnie (jeśli sprzęt do tworzenia gradientu nie jest dostępny) eluuj związane białka za pomocą 5 objętości kolumny buforu startowego + NaCl o wybranej sile jonowej. Powtórzyć przy wyższych mocach jonowych, aż docelowe białko(a) zostanie(ą) wymyte.
- Płukać 5 objętościami kolumny 1 M NaCl (100%B) w celu wymycia pozostałego materiału związanego jonowo.
- Re-wyrównać za pomocą 5-10 objętości kolumny buforu startowego lub do momentu, gdy pH eluentu i przewodność osiągną wymagane wartości.
Kroki te są wyróżnione w całej tej sekcji.
Objętości buforów, o których mowa, są wyrażone w objętościach kolumn, na przykład 3 CV=3 ml dla kolumny o objętości złoża 1 ml. Użycie objętości kolumny do opisania profilu separacji ułatwia opracowywanie metod i przenoszenie metod na kolumny o różnych wymiarach.
Liczbę objętości kolumn używanych na każdym etapie separacji można często zmniejszyć poprzez optymalizację. Na przykład, mniej buforu jest wymagane do wyrównania silnego wymieniacza jonowego, objętość gradientu może być zmniejszona, jeśli rozdzielczość może być utrzymana, a mniej buforu może być wymagane do płukania podczas rozdzielania mniej złożonych i dość czystych próbek.
PH i siła jonowa
PH i siła jonowa buforu muszą być zgodne ze stabilnością i aktywnością białka. Najbardziej odpowiednie pH powinno umożliwiać wiązanie interesujących białek, ale powinno być jak najbliżej punktu uwalniania (elucji). Jeśli pH jest zbyt niskie lub zbyt wysokie, elucja staje się trudniejsza i może być potrzebne wysokie stężenie soli. Należy tego unikać, ponieważ niektóre białka zaczynają się wytrącać przy wysokiej sile jonowej, a wysokie stężenia soli mogą zakłócać testy lub kolejne etapy chromatografii.
Unikaj ekstremalnych zmian pH lub innych warunków, które mogą powodować inaktywację lub nawet wytrącanie.
pH i siła jonowa próbki są niezwykle ważne dla osiągnięcia najbardziej efektywnej wysokiej rozdzielczości lub separacji grupowej i maksymalnego wykorzystania wysokiej pojemności ładunkowej. Idealnie byłoby, gdyby próbki znajdowały się w takich samych warunkach jak bufor początkowy (Załącznik 1, Przygotowanie próbki, a w szczególności Wymiana buforu i odsalanie, strona 156 w celu uzyskania szczegółowych informacji). Podczas pracy z małymi objętościami podczas badań przesiewowych i zwiadowczych wystarczające może być rozcieńczenie próbki w buforze startowym w celu obniżenia siły jonowej i dostosowania pH do wartości podobnej do wartości buforu startowego.
Białka często zaczynają dysocjować z nośników IEX około 0,5 jednostki pH od ich punktów izoelektrycznych przy sile jonowej około 0,1 M. pH buforu startowego powinno wynosić co najmniej 0,5-1 jednostki pH powyżej pI.5-1 jednostki pH powyżej pI substancji docelowej w przypadku stosowania wymieniacza anionowego (Q, DEAE lub ANX) lub 0,5-1 jednostki pH poniżej pI substancji docelowej w przypadku stosowania wymieniacza kationowego (SP lub CM).
W przypadku próbek o nieznanych właściwościach ładunku należy wypróbować następujące metody:
- wymieniacz anionowy (Q, DEAE lub ANX)
bufor startowy: pH 8.0
bufor elucyjny: bufor startowy zawierający 1 M NaCl, pH 8.0 - wymiana kationów (S, SP, CM)
bufor startowy: pH 6.0
bufor elucyjny: bufor startowy zawierający 1 M NaCl, pH 6,0
Zalecenia dotyczące lotnych i nielotnych układów buforowych dla wymieniaczy anionowych i kationowych znajdują się w Załączniku 2 .
W miarę możliwości należy sprawdzić stabilność przy wybranych wartościach pH i siły jonowej, zwłaszcza jeśli priorytetem jest odzyskanie aktywności biologicznej.
Wymiennik jonowy lub kationowy
Dla cząsteczek takich jak kwasy nukleinowe, które zawierają tylko grupy naładowane ujemnie, oczywistym wyborem jest wymiennik anionowy. Jednakże, ponieważ ładunek netto cząsteczek takich jak białka (niosące dodatnio i ujemnie naładowane grupy) zależy od pH, wybór opiera się na tym, który typ wymiennika i pH dają pożądaną rozdzielczość w ramach ograniczeń stabilności próbki. Na przykład rysunek 18 przedstawia teoretyczne białko, które ma dodatni ładunek netto poniżej punktu izoelektrycznego i może wiązać się z wymieniaczem kationowym. Powyżej punktu izoelektrycznego białko ma ładunek ujemny netto i może wiązać się z wymieniaczem anionowym. Jednak białko jest stabilne tylko w zakresie pH 5-8, dlatego należy użyć wymieniacza anionowego.

Rysunek 18.Rozważania przy wyborze odpowiedniego nośnika IEX
Jeśli składniki próbki są najbardziej stabilne poniżej ich punktów izoelektrycznych, należy użyć wymieniacza kationowego.
Jeśli składniki próbki są najbardziej stabilne powyżej ich punktów izoelektrycznych, należy użyć wymieniacza anionowego.
Jeśli stabilność jest wysoka w szerokim zakresie pH po obu stronach punktu izoelektrycznego, należy użyć dowolnego typu wymieniacza jonowego.
Silne lub słabe wymieniacze jonowe
Tabela 3 przedstawia grupy funkcyjne stosowane w nośnikach IEX. Terminy silny i słaby odnoszą się do stopnia, w jakim stan jonizacji grup funkcyjnych zmienia się w zależności od pH. Terminy silny i słaby nie odnoszą się do siły, z jaką grupy funkcyjne wiążą się z białkami.
Zacznij od silnego wymieniacza, aby umożliwić prowadzenie prac rozwojowych w szerokim zakresie pH. Użyj silnego wymieniacza anionowego (Q), aby związać interesujące białko (białka), jeśli ich punkt izoelektryczny jest poniżej pH 7,0 lub nieznany.
Użyj silnego wymieniacza w tych przypadkach, w których maksymalna rozdzielczość występuje przy ekstremalnym pH, a interesujące białka są stabilne przy tym pH.
Rozważ użycie słabego wymieniacza, jeśli selektywność silnego wymieniacza jonowego jest niezadowalająca, ale pamiętaj, że zdolność jonowymienna słabego wymieniacza jonowego zmienia się w zależności od pH. W rezultacie:
- zdolność ładowania (wiązania) próbki może zmieniać się wraz ze wzrostem pH z powodu utraty ładunku z wymiennika.
- na rozdzielczość łatwiej wpływają zmiany natężenia przepływu lub obciążenia próbki ze względu na pośrednie formy interakcji ładunku, które mogą wystąpić.
- przewidywane wyniki (oparte na znanych informacjach o składnikach próbki, takich jak ich punkty izoelektryczne i sposób, w jaki ich ładunek powierzchniowy netto zmienia się wraz z pH) mogą nie korelować z rzeczywistymi wynikami, ponieważ liczba naładowanych grup na słabych wymieniaczach jonowych może zmieniać się wraz z pH.
- w celu miareczkowania słabych grup funkcyjnych wymieniaczy jonowych mogą być wymagane dłuższe czasy równowagi.
Przy stosowaniu słabego wymieniacza należy pracować w zakresie podanych poniżej wartości pH, aby zminimalizować wahania wydajności:
DEAE: pH 2-9
ANX: pH 2-9
CM: pH 6-10
Wybór i przygotowanie buforu
Jony buforujące
.Jony buforujące powinny mieć taki sam ładunek jak grupy funkcyjne na nośniku IEX (jony buforujące, które mają ładunek przeciwny do ładunku grup funkcyjnych, będą uczestniczyć w procesie wymiany jonowej i mogą powodować znaczne wahania pH podczas elucji), a najlepiej wartość pKa w granicach 0,6 jednostki pH.6 jednostek pH od pH roboczego. Wyjątkiem od tej reguły jest częste stosowanie buforów fosforanowych w separacjach anionowymiennych. Jednak bufory fosforanowe muszą być bardzo starannie przygotowane, aby zapewnić powtarzalność między partiami.
Używaj stężenia buforu, które jest wystarczające do utrzymania zdolności buforowania i stałego pH, zwykle 20-50 mM.
Używaj lotnych buforów, jeśli oczyszczony produkt ma być liofilizowany.
Załącznik 2 dla zaleceń dotyczących lotnych i nielotnych systemów buforowych dla wymieniaczy anionowych i kationowych.
Filtruj bufory po dodaniu wszystkich soli i dodatków. Używaj wysokiej jakości wody i chemikaliów. Filtruj roztwory przez filtry 1 μM dla cząstek o wielkości powyżej 90 μM, filtry 0,45 μM dla cząstek 34 μM lub filtry 0,22 μM dla cząstek o wielkości poniżej 15 μM lub gdy wymagane są sterylne lub bardzo czyste próbki. Aby uniknąć tworzenia się pęcherzyków powietrza w upakowanej kolumnie, upewnij się, że kolumna i bufory mają tę samą temperaturę podczas przygotowywania do pracy.
Wpływ temperatury na pH buforu
Wybierz bufory, które mają odpowiednie wartości pKa dla temperatury roboczej. Wartość pKa substancji buforującej zmienia się w zależności od temperatury. Na przykład Tris™ ma pKa 8,85 w temperaturze 0 °C, 8,06 w temperaturze 25 °C i 7,72 w temperaturze 27 °C. Użycie Tris w temperaturze 4 °C przy pH 7,9 dałoby bardzo niską zdolność buforowania, a robocze pH byłoby poza użytecznym zakresem pH (pKa + 0,5) buforu.
Przygotuj bufory w tej samej temperaturze, w której będą używane.
Temperatury <10 °C mogą zminimalizować agregację spowodowaną oddziaływaniami hydrofobowymi między składnikami próbki. Praca w tych niższych temperaturach może być alternatywnym rozwiązaniem dla użycia detergentu w celu poprawy rozpuszczalności.
Przeciwjon
Przeciwjonami (jonami soli) stosowanymi w IEX są prawie zawsze Na+ do wymiany kationów i Cl- do wymiany anionów.
Sole, takie jak NaCl, mają charakter chaotropowy (tj. zdolność do zmniejszania polarności wody), a zatem mniejszy efekt "wysalania" na cząsteczkach hydrofobowych. Zapewnia to maksymalną rozpuszczalność podczas elucji i poprawia odzysk. Sole chaotropowe mogą być również stosowane w obecności rozpuszczalników organicznych, jeśli jest to wymagane. Należy unikać soli takich jak (NH4)2SO4 lub K3PO4, ponieważ najprawdopodobniej spowodują one wytrącanie w wysokich stężeniach.
W niektórych zastosowaniach alternatywne przeciwjony, takie jak Li+, Br-, I-, SO42-, CH3COO- lub
HCOO- mogą poprawić, a nawet zmienić, selektywność, ponieważ wykazują różne siły elucji, ale należy zauważyć, że użycie tych jonów może wpłynąć na zdolność wiązania pożywki.
Rysunek 19 pokazuje, jak selektywność i rozdzielczość mogą się różnić przy użyciu różnych przeciwjonów.

Rysunek 19.Wpływ przeciwjonów na selektywność i rozdzielczość (Mono Q HR 5/5 teraz dostępny jako Mono Q 5/50 GL). Należy zwrócić uwagę na różną kolejność elucji pików 3 i 4.
Użyj następującej procedury, jeśli medium ma być używane z przeciwjonami innymi niż sód lub chlorek:
- Przepłucz wypełnioną kolumnę 10 objętościami 0,5-1 M roztworu soli zawierającego nowy przeciwjon.5-1 M roztworem soli zawierającym nowy przeciwjon.
- Przepłukać kolumnę 10 objętościami buforu startowego przy takim samym natężeniu przepływu jak w kroku 1.
- Powtórzyć kroki 1 i 2 kilka razy.
Wykonaj ślepą próbę w celu sprawdzenia przewodności i pH.
Przygotowanie kolumny i mediów
Kolumnę należy skalibrować za pomocą 5-10 objętości buforu startowego lub do momentu, gdy linia bazowa, pH eluentu i przewodność będą stabilne.
Używanie wstępnie zapakowanych kolumn jest wysoce zalecane, aby zapewnić najlepszą wydajność i powtarzalne wyniki. Równomiernie wypełniona kolumna zapewnia, że piki składników nie są niepotrzebnie poszerzane, gdy próbka przechodzi w dół kolumny, dzięki czemu można osiągnąć najlepszą rozdzielczość.
Pozwól buforom, nośnikom lub wstępnie zapakowanym kolumnom osiągnąć tę samą temperaturę przed użyciem. Gwałtowne zmiany temperatury, na przykład usunięcie zapakowanych kolumn z zimnego pomieszczenia, a następnie zastosowanie buforu w temperaturze pokojowej, mogą powodować powstawanie pęcherzyków powietrza w opakowaniu i wpływać na rozdzielanie.
Przed użyciem jakiegokolwiek medium IEX należy zmyć roztwory do przechowywania i środki konserwujące.
Zwiększ objętości używane do wyrównania kolumny przed pierwszym uruchomieniem, jeśli używasz buforów zawierających detergenty lub przeciwjon inny niż ten, w którym medium było przechowywane.
Załącznik 3 zawiera szczegółowe informacje na temat pakowania kolumn. Objętość wymagana dla upakowanego złoża zależy od ilości próbki do oczyszczenia i zdolności wiązania pożywki. Zapakuj kolumnę, która będzie miała około 5-krotny nadmiar wymaganej zdolności wiązania przy wysokości złoża do 20 cm.
Regularnie sprawdzaj wydajność kolumny, określając wydajność kolumny i symetrię piku. Dodatek 3. Należy pamiętać, że nie dotyczy to kolumn HiTrap lub HiPrep™.
Przygotowanie próbki
Prawidłowe przygotowanie próbki i buforu ma zasadnicze znaczenie dla osiągnięcia optymalnej separacji i uniknięcia pogorszenia wydajności kolumny. Proste kroki mające na celu oczyszczenie próbki przed nałożeniem jej na kolumnę pozwolą uniknąć ryzyka zablokowania i zmniejszą potrzebę stosowania rygorystycznych procedur płukania. Dodatek 1 zawiera szczegółowy przegląd technik przygotowywania próbek.
Odsolić próbki i przenieść do wybranego buforu początkowego (szczegółowe informacje na temat wymiany buforu i odsalania znajdują się na stronie 156). pH i siła jonowa próbki są niezwykle ważne w celu osiągnięcia najbardziej efektywnej wysokiej rozdzielczości lub separacji grupowej i maksymalnego wykorzystania wysokiej pojemności ładowania.
W przypadku małych objętości próbek o wysokim stężeniu soli i bez większych zanieczyszczeń, takich jak lipidy lub detergenty jonowe, wystarczające może być rozcieńczenie próbki buforem startowym w celu obniżenia stężenia soli do poziomu, który nie zakłóca wiązania z podłożem. Jednak wymiana buforu i odsalanie jest jedynym sposobem na zagwarantowanie prawidłowych warunków pH i siły jonowej próbki.
Próbki muszą być czyste i wolne od cząstek stałych, szczególnie podczas pracy z cząstkami o wielkości 34 μM lub mniejszej. W przypadku małych objętości próbek, filtr strzykawkowy z octanu celulozy lub PVDF może być wystarczający do filtracji próbki.
Stężenie i lepkość
Rozpuszczalność lub lepkość próbki może ograniczać ilość, która może być zastosowana w kolumnie. Wysoka lepkość próbki może powodować niestabilność separacji i nieregularny wzór przepływu, co skutkuje szerokimi, zniekształconymi pikami i problemami z przeciwciśnieniem. Krytycznym parametrem jest lepkość próbki w stosunku do lepkości eluentu.
Próbki lepkie należy rozcieńczyć buforem startowym. Jeśli wysoka lepkość jest spowodowana obecnością zanieczyszczeń kwasami nukleinowymi, w Załączniku 1 znajdują się porady dotyczące ich usuwania. Należy pamiętać, że lepkość zmienia się w zależności od temperatury. Jeśli rozcieńczenie nie wchodzi w grę, użycie medium o większym rozmiarze cząstek może pomóc w przezwyciężeniu problemów związanych z lepkością.
Próbki generalnie nie powinny przekraczać 50-70 mg/mL białka, ale mogą się różnić w zależności od rodzaju próbki i rodzaju medium chromatograficznego.
Nakładanie próbki
Dostosuj próbkę do wybranego początkowego pH i siły jonowej (przygotowanie próbki) i nałóż na kolumnę.
Przepłukać kolumnę 5-10 objętościami buforu startowego lub do momentu, gdy linia bazowa, pH eluentu i przewodność będą stabilne, tj. gdy cały niezwiązany materiał zostanie przepłukany przez kolumnę.
Warunki początkowe powinny maksymalizować wiązanie białek docelowych w pobliżu górnej części kolumny i, jeśli to możliwe, minimalizować wiązanie zanieczyszczeń, tak aby przechodziły przez kolumnę.
Dla skutecznego wiązania próbka powinna mieć takie samo pH i siłę jonową jak bufor początkowy. Objętość próbki może być stosunkowo duża bez wpływu na separację, ponieważ próbka będzie wiązać się w górnej części kolumny, o ile warunki równowagi i próbki są prawidłowe.
Nałóż próbki bezpośrednio na kolumnę za pomocą systemu chromatograficznego, pompy perystaltycznej lub strzykawki. Wybór sprzętu zależy w dużej mierze od objętości próbki, rozmiaru kolumny, rodzaju medium IEX i wymagań dotyczących dokładności elucji gradientowej. Upewnij się, że górna część złoża kolumny nie została naruszona podczas nakładania próbki
Nie zmieniaj warunków buforowania, dopóki cały niezwiązany materiał nie zostanie przepłukany przez kolumnę (monitorowany przez absorbancję UV) i dopóki wartości UV i przewodności nie powrócą do warunków początkowych.
Obciążenie próbki
Obciążenie próbki (masa) ma większe znaczenie niż objętość próbki. Ilość próbki, którą można nanieść na kolumnę, zależy od dynamicznej zdolności wiązania medium IEX i wymaganego stopnia rozdzielczości. Obciążenie próbki ma duży wpływ na rozdzielczość, ponieważ szerokość pików jest bezpośrednio związana z ilością obecnej substancji, jak pokazano na rysunku 20. W związku z tym, aby osiągnąć zadowalającą rozdzielczość, całkowita ilość białka zastosowanego i związanego z podłożem nie powinna przekraczać całkowitej zdolności wiązania upakowanej kolumny.

Rysunek 20.Wpływ zwiększenia obciążenia próbki na rozdzielczość.
Zastosowanie do 30% całkowitej pojemności wiązania kolumny w celu uzyskania optymalnej rozdzielczości przy elucji gradientowej. Obciążenie próbki można zwiększyć, jeśli rozdzielczość jest zadowalająca lub w przypadku stosowania elucji krokowej.
Jeśli objętości próbek są duże w porównaniu do całkowitej objętości kolumny, skład buforu próbki, w szczególności siła jonowa, powinien być taki sam jak buforu początkowego, aby zapewnić odpowiednie warunki wiązania.
Rozdział 3 podaje typowe zdolności wiązania dla każdego medium jako wytyczne dla całkowitej zdolności wiązania. Na rzeczywistą (dynamiczną) zdolność wiązania mają również wpływ takie czynniki jak wielkość i kształt cząsteczek, wielkość porów matrycy, szybkość przepływu, stężenie próbki, pH/ładunek białka i siła jonowa. Wydajność zmniejsza się w przypadku cząsteczek o bardzo dużej średnicy lub długości, np. kompleksów białkowych o masie cząsteczkowej 400 000, asymetrycznych białek i DNA. Cząsteczki te nie są w stanie przeniknąć przez pory matrycy, ograniczając ich wiązanie głównie do naładowanych grup na powierzchni matrycy. Ponieważ dokładny rozkład wielkości porów w niektórych matrycach może się różnić, a pozorna wielkość cząsteczki może się różnić w zależności od warunków buforowych, nie ma wyraźnego punktu odcięcia masy cząsteczkowej, w którym cząsteczki mogą lub nie mogą przenikać przez pory matrycy.
Etap wiązania i dynamiczna zdolność wiązania mogą zostać zwiększone poprzez zastosowanie próbki o pH, w którym docelowe białko ma wyższy ładunek niż w przypadku zastosowania optymalnego pH do separacji.
Objętość próbki
Jako technika wiązania, IEX jest niezależna od objętości próbki, o ile siła jonowa próbki jest taka sama lub tak niska jak bufor początkowy, a białka docelowe są wystarczająco naładowane przy wybranym pH. Duże objętości rozcieńczonych roztworów, takich jak frakcje z etapu odsalania lub supernatant hodowli komórkowej, mogą być stosowane bezpośrednio do pożywki IEX bez wcześniejszego zatężania.
Elucja
Związane białka są eluowane przez kontrolowane zmiany siły jonowej lub pH. Sposób, w jaki zachodzą te zmiany, poprzez zastosowanie elucji liniowej lub stopniowej, jest wybierany zgodnie z celem separacji:
- Liniowa elucja gradientowa
- separacja lub analiza o wysokiej rozdzielczości
- zoptymalizowana elucja gradientowa przy zwiększonej prędkości przy zachowaniu wymaganej rozdzielczości - Elucja etapowa
- krótszy czas separacji, mniejsze zużycie buforu
- separacja grupowa
Liniowa elucja gradientowa
Cel: rozdzielanie lub analiza z wysoką rozdzielczością, przesiewanie
Rozpocznij elucję stosując gradient liniowy o objętości 10-20 objętości kolumny z rosnącą siłą jonową do 0.5 M NaCl (50%B).

Rysunek 21.Typowy rozdział IEX przy użyciu liniowej elucji gradientowej. Ślady UV (białko) i przewodnictwa (sól) pokazują elucję pików białka i zmiany stężenia soli podczas elucji.
Liniowe gradienty siły jonowej, jak pokazano na Rysunku 21, są najczęściej stosowanym typem elucji i powinny być zawsze stosowane przy rozpoczynaniu od nieznanej próbki (gdy jak najwięcej składników jest związanych z kolumną i eluowanych różnicowo, aby zobaczyć całkowity profil białka). Przy niskiej sile jonowej konkurencja o naładowane grupy na podłożu IEX jest minimalna. Zwiększenie siły jonowej zwiększa konkurencję i zmniejsza interakcję między medium a związanymi substancjami, które zaczynają eluować. Bufor elucyjny ma zwykle taką samą sól buforową i pH jak bufor początkowy, ale zawiera dodatkową sól, najczęściej chlorek sodu.
Zaleca się stosowanie liniowej elucji gradientowej podczas opracowywania metody. Liniowe gradienty siły jonowej są łatwe do przygotowania i bardzo powtarzalne, gdy są generowane przez odpowiedni system chromatograficzny. Uzyskane wyniki mogą następnie służyć jako podstawa do optymalizacji separacji.
Rezydencja naładowanych białek na podłożu jest związana z objętością kolumny i różnicą stężeń w jej poprzek:
- długie, płytkie gradienty dają maksymalną separację między pikami, ale czasy separacji będą dłuższe i nastąpi większe poszerzenie piku.
- krótkie, strome gradienty zapewniają szybszą separację i ostrzejsze piki, ale piki będą eluowane bliżej siebie.
- piki eluowane później w gradiencie mają tendencję do bycia nieco szerszymi niż te eluowane wcześnie.
Wybierz najbardziej stromy gradient, aby uzyskać akceptowalną rozdzielczość przy wybranym pH.
Wpływ nachylenia gradientu pokazano na Rysunku 22.

Rysunek 22.Wpływ nachylenia gradientu na rozdzielczość, w teorii i w praktyce.
Jeśli objętość elucji gradientu zostanie zmniejszona, może być konieczne proporcjonalne zmniejszenie obciążenia próbki w celu utrzymania tej samej rozdzielczości. Podobnie, jeśli obciążenie próbki zostanie zwiększone (w ramach całkowitej pojemności kolumny), może być konieczne zwiększenie objętości gradientu w celu utrzymania rozdzielczości.
Gradienty najlepiej tworzyć przy użyciu specjalnie zaprojektowanego sprzętu, takiego jak systemy ÄKTAdesign z zaprogramowanymi szablonami metod, które automatycznie kontrolują mieszanie roztworów dostarczanych do kolumny. Użytkownicy systemów ÄKTAdesign z funkcją BufferPrep mogą wybierać spośród szeregu receptur buforów w celu przeprowadzenia elucji gradientu soli przy stałym pH.
BufferPrep automatycznie oblicza i miesza prawidłowe proporcje roztworów podstawowych w celu utrzymania stałego pH podczas całego przebiegu. Alternatywnie, systemy mogą wykorzystywać dwie oddzielne pompy do buforów startowych i elucyjnych lub pojedynczą pompę w połączeniu z zaworem przełączającym do mieszania buforów.
Dokładne przygotowanie buforu, wydajne mieszanie i najkrótsza możliwa ścieżka przepływu między mieszalnikiem a górną częścią kolumny pomogą zapewnić dokładne tworzenie gradientu.
Cel: skrócenie czasu separacji, utrzymanie rozdzielczości
W przypadku niektórych separacji, gdy ustalono warunki dla separacji o wysokiej rozdzielczości przy użyciu gradientu liniowego, możliwe jest skrócenie całkowitego czasu separacji poprzez zastosowanie bardziej złożonego profilu elucji, jak zilustrowano na Rysunku 23. Płytkie gradienty mogą być stosowane tam, gdzie wymagana jest maksymalna rozdzielczość, podczas gdy bardziej strome gradienty mogą być stosowane w obszarach, w których rozdzielczość jest zadowalająca.
Rysunek 23.Złożone profile gradientu mogą skrócić całkowity czas separacji dla niektórych separacji.
Elucja etapowa
Elucja związanych białek za pomocą 5 objętości kolumny buforu startowego + NaCl o wybranej sile jonowej.
Powtarzaj z wyższymi siłami jonowymi, aż docelowe białko (białka) zostanie wymyte.

Rysunek 24.Typowa separacja IEX przy użyciu elucji krokowej. Ślady UV (białko) i przewodnictwa (sól) pokazują elucję pików białka i zmiany stężenia soli podczas elucji.
Jak pokazano na Rysunku 24, elucja etapowa jest wykonywana przez sekwencyjne dodawanie tego samego buforu o rosnącej sile jonowej. Elucja etapowa jest technicznie prosta, ale należy zachować ostrożność przy projektowaniu etapów i interpretacji wyników, ponieważ substancje eluowane przez gwałtowną zmianę siły jonowej eluują blisko siebie, dając fałszywy pik, który może zawierać kilka składników. Piki mają zwykle ostre fronty i wyraźne ogonowanie, ponieważ często zawierają więcej niż jeden składnik. Ogonowanie może prowadzić do pojawienia się fałszywych pików, jeśli zmiana siły jonowej zostanie wprowadzona zbyt wcześnie. Z tych powodów zaleca się stosowanie liniowego gradientu siły jonowej podczas opracowywania nowej metody.
Cel: krótszy czas separacji, mniejsze zużycie buforu
Gdy separacja IEX została zoptymalizowana przy użyciu elucji gradientowej, zmiana na elucję etapową zmniejsza całkowitą liczbę objętości kolumn używanych do separacji. Przyspiesza to czas separacji i zmniejsza zużycie buforu przy jednoczesnym zachowaniu wymaganego poziomu czystości. Elucja etapowa tego typu jest często stosowana do rutynowej separacji na dużą skalę. Dodatkową zaletą elucji etapowej stosowanej na większą skalę jest to, że często możliwe jest zastosowanie większej ilości próbki, ponieważ cząsteczki, które eluowałyby wcześnie w separacji gradientowej, nie zajmują już zdolności wiązania na kolumnie.
Cel: separacja grupowa
W separacji grupowej cząsteczki będące przedmiotem zainteresowania są zagęszczane i szybko usuwane z niepożądanych substancji. Gdy warunki wiązania i elucji dla docelowego białka (białek) i zanieczyszczeń zostały określone, zwykle podczas wstępnych separacji elucji gradientowej, warunki są wybierane w celu maksymalizacji wiązania docelowego białka (białek) i zminimalizowania wiązania zanieczyszczeń podczas nakładania próbki. Docelowe białko (białka) jest następnie eluowane przez pojedynczą zmianę buforu we wzbogaconej, skoncentrowanej formie. Rysunek 25 przedstawia przykład takiego rozdziału, w którym kolumna HiTrap Q HP jest używana do oddzielania białek ludzkiej surowicy od niepożądanej frakcji IgG, która przechodzi bezpośrednio przez kolumnę.
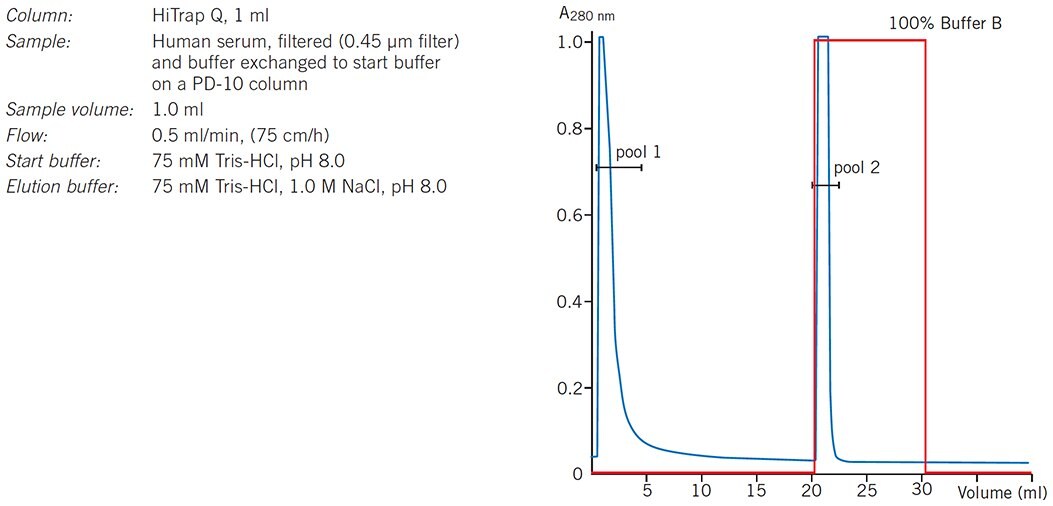
Rysunek 25.Grupowa separacja białek surowicy na HiTrap Q HP.
Cel: usuwanie zanieczyszczeń
Jeśli warunki początkowe zostały wybrane tak, aby zmaksymalizować wiązanie zanieczyszczeń, wówczas nie jest wymagana zmiana warunków elucji, ponieważ docelowe białko (białka) przejdzie przez kolumnę. W przypadku wielu zastosowań lepiej jest wyrzucić kolumnę niż poświęcać czas i wysiłek na usuwanie niepożądanych związanych substancji.
elucja pH
Ponieważ ładunek netto białka zależy od pH, próbki mogą być również eluowane z podłoża IEX poprzez zmianę pH buforu elucyjnego. Ponieważ nie ma gradientu soli, próbki są po prostu zatrzymywane na kolumnie przy jednym pH i eluowane poprzez zwiększanie lub zmniejszanie pH. Różne naładowane grupy w próbce lub na kolumnie są miareczkowane, aż staną się neutralne lub przeciwnie naładowane do medium, a próbka eluuje.
- Białka związane z wymieniaczem anionowym (Q, DEAE, ANX) będą eluować wraz ze spadkiem pH.
- Białka związane z wymieniaczem kationowym (SP, S, CM) będą eluować wraz ze wzrostem pH.
Ponieważ elucja pH będzie wymagała pracy przy wartościach pH zbliżonych do punktu izoelektrycznego białka, a wiele białek wykazuje minimalną rozpuszczalność w pobliżu ich punktów izoelektrycznych, należy podjąć środki ostrożności, aby uniknąć wytrącania na kolumnie.
Zawsze testuj z wyprzedzeniem rozpuszczalność składników próbki przy pH i stężeniach soli, które mają być użyte podczas separacji.
W przypadku każdego rodzaju elucji pH należy zachować ostrożność przy wyborze i mieszaniu systemów buforowych w celu uzyskania powtarzalności. Stopniowa elucja pH jest łatwiejsza do wykonania i bardziej powtarzalna niż stosowanie liniowego gradientu pH. Należy pamiętać, że w przypadku słabych wymieniaczy jonowych bufor może być zmuszony do miareczkowania naładowanych grup na podłożu i nastąpi krótki okres ponownego wyrównania przed osiągnięciem nowego pH.
Liniowe gradienty pH są bardzo trudne do wytworzenia przy stałej sile jonowej, ponieważ występują również jednoczesne zmiany siły jonowej, choć niewielkie. Gradientów tych nie można uzyskać po prostu przez zmieszanie buforów o różnym pH w liniowych stosunkach objętościowych, ponieważ zdolności buforujące wytworzonych układów zależą od pH. Względnie liniowy gradient można uzyskać w wąskim przedziale pH (maksymalnie 2 jednostki pH) przez zmieszanie dwóch roztworów tej samej soli buforowej dostosowanej do 1 jednostki pH powyżej i 1 jednostki pH poniżej pKa dla buforu.
Ogólnie rzecz biorąc, rozdzielanie białek zgodnie z ich punktami izoelektrycznymi, przy użyciu chromatofokusowania, prawdopodobnie zapewni bardziej wiarygodne wyniki o wyższej rozdzielczości niż próba elucji białek z kolumny IEX przy użyciu gradientu pH.
Natężenia przepływu
Maksymalne natężenie przepływu stosowane podczas separacji może się różnić w zależności od etapu separacji. Na przykład, podczas nakładania próbki i elucji, niższe szybkości przepływu dają czas składnikom próbki na dyfuzję do i z porów, gdy wiążą się lub dysocjują z grupami funkcyjnymi. Rysunek 26 przedstawia przykład wpływu szybkości przepływu na rozdzielczość. Wyższe szybkości przepływu mogą być stosowane do wyrównywania, płukania i ponownego wyrównywania, ograniczone przede wszystkim sztywnością mediów i specyfikacjami ciśnienia sprzętu.
Zalecane szybkości przepływu dla każdego medium chromatograficznego podano w Rozdziale 3. Korzystając z tych zaleceń, wybierz najwyższe natężenie przepływu, które utrzymuje rozdzielczość i minimalizuje czas separacji. Na przykład, jeśli piki są dobrze rozdzielone przy niskim natężeniu przepływu, należy zwiększyć natężenie przepływu lub, alternatywnie, zwiększyć objętość próbki, aby skorzystać z wyższej wydajności bez znaczącej utraty rozdzielczości.

Rysunek 26.Wpływ rosnącego natężenia przepływu na rozdzielczość.
Prędkość przepływu jest mierzona w prostych kategoriach objętościowych, np. ml/min, ale podczas porównywania wyników między kolumnami o różnych rozmiarach lub podczas skalowania, przydatne jest użycie przepływu liniowego: cm/godzinę (Załącznik 5). Wyniki uzyskane przy tym samym przepływie liniowym na kolumnach o różnych rozmiarach będą porównywalne, jeśli chodzi o wpływ natężenia przepływu.
Oszczędzaj czas, stosując wyższe natężenia przepływu podczas etapów płukania wysoką solą i ponownego wyrównywania. Nie należy przekraczać maksymalnego zalecanego przepływu dla danego medium.
Wyższe natężenia przepływu i lepkie bufory zwiększają ciśnienie robocze (należy pamiętać, że lepkość buforu zwiększa się podczas pracy w temperaturze +4 °C). Sprawdź maksymalne ciśnienie robocze upakowanej kolumny i odpowiednio ustaw górny limit ciśnienia w systemie chromatograficznym.
Kontrola przepływu
Dokładna, powtarzalna kontrola przepływu jest niezbędna dla dobrej rozdzielczości i powtarzalności.
Używaj pompy w systemie chromatograficznym (zamiast pompy perystaltycznej), aby w pełni wykorzystać wysoką sztywność i doskonałe właściwości przepływu mediów, takich jak MiniBeads, MonoBeads, SOURCE lub Sepharose High Performance.
Zawsze pompuj bufor na kolumnę (zamiast przeciągać bufor przez kolumnę za pomocą pompy poniżej). Zmniejsza to ryzyko tworzenia się pęcherzyków w wyniku zasysania. W przypadku samodzielnego pakowania kolumny, należy zawsze używać natężenia przepływu do separacji, które jest mniejsze niż natężenie przepływu używane do pakowania kolumny, aby uniknąć kurczenia się złoża kolumny przez wzrost ciśnienia, który może wystąpić podczas pracy z próbką.
Płukanie i ponowne wyrównanie
Płukanie 5 objętościami kolumny 1 M NaCl (100%B) w celu elucji wszelkich pozostałości materiału związanego jonowo.
Włącz etap płukania na końcu każdego przebiegu w celu usunięcia wszelkich cząsteczek, które są nadal związane z podłożem. Monitoruj absorbancję UV, aby w razie potrzeby skrócić lub wydłużyć etap płukania.
Re-kalibruj za pomocą 5-10 objętości buforu startowego lub do momentu, gdy pH i przewodność eluentu osiągną wymagane wartości.
Krok ponownej kalibracji po płukaniu przywraca kolumnę do warunków początkowych przed zastosowaniem kolejnych próbek. O ile to możliwe, należy monitorować pH i przewodność, aby sprawdzić, kiedy warunki początkowe zostały osiągnięte. Etap ponownej kalibracji można następnie skrócić lub wydłużyć w zależności od potrzeb.
Zwiększ natężenie przepływu podczas etapów płukania i ponownej kalibracji, aby zaoszczędzić czas między kolejnymi przebiegami.
Jeśli użyto detergentów jonowych, umyj kolumnę 5 objętościami wody destylowanej, a następnie 2 objętościami 2 M NaCl. Ponownie skalibrować za pomocą co najmniej 10 objętości kolumny buforu startowego, aż linia bazowa UV, pH eluentu i/lub przewodność będą stabilne. Rozpuszczalniki organiczne, takie jak etanol, mogą być używane do usuwania niejonowych detergentów. Wybierając rozpuszczalnik organiczny, należy sprawdzić stabilność chemiczną medium, aby określić odpowiednie stężenie.
Detergenty, środki denaturujące i inne dodatki
Wszelkie dodatki stosowane do dysocjacji, solubilizacji, chelatowania metali, hamowania enzymów itp. powinny być zawsze sprawdzane pod kątem ich charakterystyki ładunku przy roboczym pH. Wykonaj gradienty ślepej próby z dodatkami w celu sprawdzenia ich wpływu na profil chromatograficzny.
Dodatki stosowane podczas przygotowywania próbki zostaną oddzielone od składników próbki podczas IEX. Jeśli zauważysz, że białka wytrącają się, eluują później niż oczekiwano lub są słabo rozdzielone, dodaj odpowiednie stężenie dodatków użytych do wstępnej solubilizacji do buforów startowych i elucyjnych.
Dodatki dwubutelkowe, takie jak betaina, mogą zapobiegać wytrącaniu się osadu i mogą być stosowane w wysokich stężeniach bez zakłócania elucji gradientowej.
Detergenty są przydatne jako środki solubilizujące białka o niskiej rozpuszczalności w wodzie, takie jak składniki błon. Anionowe, kationowe, zwitterionowe i niejonowe (neutralne) detergenty mogą być stosowane podczas chromatografii IEX.
Środki denaturujące, takie jak chlorowodorek guanidyny lub mocznik, mogą być stosowane do wstępnej solubilizacji próbki i podczas rozdzielania. Należy ich jednak unikać, chyba że denaturacja jest wymagana. Należy pamiętać, że przy wartościach pH stosowanych do separacji, guanidyna jest naładowaną cząsteczką z przeciwjonem i dlatego będzie uczestniczyć w procesie wymiany jonowej w taki sam sposób jak NaCl.
Przykłady powszechnie stosowanych detergentów i środków denaturujących podano w tabeli 4.
.Opracowanie lub optymalizacja separacji przy użyciu buforów zawierających detergenty
- Wybierz detergenty, które są kompatybilne z próbką. Detergent musi być neutralny, zwitterionowy lub mieć taki sam ładunek jak podłoże IEX. Detergenty, które wiążą się z pożywką mogą być trudne do usunięcia i mogą wpływać na zdolność ładowania białek, pH, przewodność i rozdzielczość.
- Określ minimalne stężenie, które prawdopodobnie utrzyma próbkę w roztworze podczas separacji. Należy pamiętać, że różne detergenty będą miały różne właściwości solubilizacji, co skutkuje różnymi profilami pików.
- Dokładnie wyrównaj kolumnę roztworem detergentu, stosując stężenie, które jest poniżej krytycznego stężenia miceli dla określonego detergentu.
- Uruchom puste gradienty soli w celu określenia profilu absorbancji UV detergentu i wykrycia jakiegokolwiek wpływu pH. Tworzenie się miceli powoduje rozproszenie światła i pojawienie się piku podczas monitorowania UV. Jeśli problemem jest tworzenie się miceli, spróbuj wykonać następujące czynności:
- zmniejszyć stężenie detergentu tak bardzo, jak to możliwe bez pogorszenia rozpuszczalności próbki
- zwiększyć stężenie detergentu, aby uruchomić gradient powyżej krytycznego stężenia miceli (powoduje to stopniowy, a nie
nagły wzrost UV)
- zmienić gradient soli tak, aby nagła zmiana absorpcji UV nie występowała podczas przebiegu
- zmienić sole na wysoce chaotropowe, takie jak LiClO4 lub trichlorooctan sodu, które mogą być stosowane w wyższych stężeniach bez
nagłego wzrostu absorpcji UV)br> powodując tworzenie się miceli - Przeprowadź testy z próbką, aby znaleźć detergent, który zapewnia najlepszą solubilizację i rozdzielczość.
Pojedynczy pik uzyskany z "próby z detergentem" często zawiera więcej niż jeden składnik i powinien być dokładnie przeanalizowany. Wybór innego detergentu może poprawić rozdzielanie.
Zbyt wysokie stężenia detergentu zwiększą lepkość buforu, więc natężenie przepływu musi zostać zmniejszone, aby uniknąć nadmiernego ciśnienia w kolumnie.Stężenie detergentu wymaganego do solubilizacji można często zmniejszyć podczas separacji.
Używaj detergentów najwyższej jakości, które nie zawierają soli. Filtruj bufory zawierające detergenty pod słabym zasysaniem i ultradźwiękami w celu odgazowania, aby uniknąć pienienia.
Przed rozpoczęciem pracy z buforami zawierającymi detergenty dokładnie umyj wcześniej używane kolumny przy użyciu zalecanych procedur.
Odczynniki zmniejszające polarność
Glikol monoetylenowy, glicerol i podobne łagodne odczynniki zmniejszające polarność mogą być zawarte w buforach. Należy unikać wysokich stężeń (>40% w/w), ponieważ lepkość buforu wzrośnie i może spowodować nadmierne ciśnienie w kolumnie.
Chelatory metali: EDTA, EGTA
EDTA (kwas etylenodiaminotetraoctowy) i EGTA (kwas etylenoglikol-bis-(2-aminoetylo)-N,N,N',N'-tetraoctowy) są często stosowane w buforach jako chelatory metali i mogą być używane z chromatografią IEX. EDTA i EGTA zawierają kilka grup kwasu karboksylowego, które mogą wchodzić w interakcje z wymieniaczami anionowymi. Podczas separacji anionowymiennej EDTA i EGTA mogą koncentrować się jako pasmo na kolumnie i eluować podczas gradientu soli. Obie cząsteczki absorbują promieniowanie UV i pojawią się jako pik lub szum tła na chromatogramie.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?