Przedkliniczne

Badania przedkliniczne wykazują, że docelowy związek wykazuje bezpieczeństwo i skuteczność niezbędne do przejścia do testów na ludziach. Na tym etapie, testy in vitro i in vivo mogą wymagać kilku lat, a jeśli zakończą się sukcesem, prowadzą do przygotowania i złożenia wniosku o Investigational New Drug (IND).
Zasoby biotechnologiczne
- FDA Investigational New Drug (IND) Application
Explore FDA’s guidance on IND applications, a crucial step in drug development for biotech startups. Navigate regulatory intricacies efficiently.
- Emerging BioTalk Blog
Your gateway to the latest news in biotech. Dive into discussions on market trends, bioprocessing, and technologies for novel modalities. Join the discussion today.
- Brochure: Integrated Bioprocess Solutions
Navigate the path to commercialization with our comprehensive guide for Biopharmaceutical Startups. Accelerate your journey with our range of tools and services.
- Biopharmaceutical Application Guide
Navigate the biopharmaceutical landscape with our application guide, providing resources and solutions for mAb, ADC, and mRNA processes.
Usługi badań toksykologicznych są niezwykle ważne. Wymagane jest szerokie spektrum badań toksykologicznych in vitro i in vivo, które muszą być zaprojektowane zgodnie z międzynarodowymi wytycznymi i przeprowadzone w pełnej zgodności z przepisami dobrej praktyki laboratoryjnej (GLP).
Uwagi dotyczące rozwoju procesu
- Rozwój linii komórkowych
- Wybór klonów
- Badania przesiewowe mediów i paszy
- Rozwój procesu wyższego szczebla
- Utworzenie głównego banku komórek
- Rozwój procesu w dół
- Rozwój formulacji
- Rozwój i optymalizacja metod analitycznych
- Wsparcie rozwoju procesu analitycznego
- Programy analityczne porównywalności leków biopodobnych
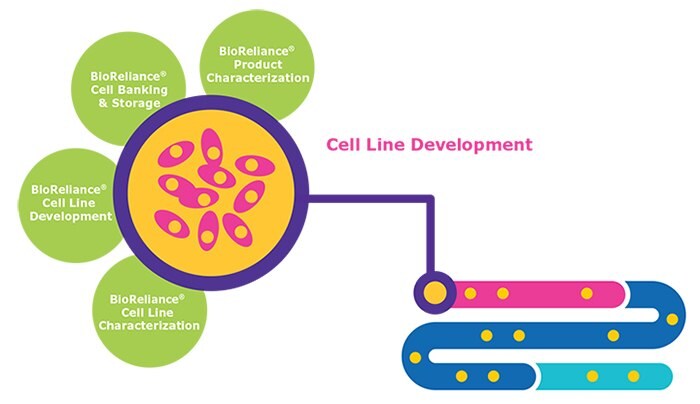
Uwagi dotyczące rozwoju linii komórkowych
- Wybór klonu - linie komórkowe, które mogą produkować lek biologiczny w wystarczającym mianie i jakości
- Badania stabilności genetycznej - badania replikujące warunki skalowania
- Stabilność genetyczna - produkcja białka powinna pozostać stabilna przez 60 pokoleń komórek.Badania solidności - badania, które replikują warunki skalowania
- Stabilność genetyczna - produkcja i jakość białka powinny pozostać stabilne po >60 generacjach komórek<
Uwagi dotyczące rozwoju procesu
- Wydajność procesu - eliminacja zbędnych etapów i wykorzystanie zdolności produkcyjnych
- Wydajność procesu - powtarzalność poprzez zwiększanie skali i transfer technologii
- Wydajność finansowa - równoważenie wydajności z kosztami

Uwagi dotyczące technologii
- Elastyczność - sprzęt jednorazowego użytku zwiększa elastyczność, umożliwia tworzenie szablonów i szybką konfigurację zestawów, a także zmniejsza koszty czyszczenia./li>
- Skalowalność - przy wyborze technologii na najwcześniejszych etapach, takich jak skalowanie bioreaktora używanego do hodowli komórek ssaków z 3 L do 200 L do 2000 L<
- Łatwość użycia - rozwiązania obejmują wstępnie zmontowane sterylne ścieżki przepływu procesu; złącza umożliwiające aseptyczne podłączanie, odłączanie i ponowne podłączanie
Uwagi regulacyjne
- Bezpieczeństwo pacjenta - kamienie milowe rozwoju klinicznego muszą oceniać bezpieczeństwo i skuteczność produktu
- Jakość produktu i solidność procesu - rozwiązania obejmują m.in.Jakość produktu i solidność procesu - gromadzenie i analiza danych są niezbędne do potwierdzenia
- Strategia składania wniosków - Znajomość krajów, w których będą dokonywane zgłoszenia, powinna kierować tym, kto przeprowadza inspekcje w zakładzie produkcyjnym
Uwagi biznesowe
- Speed to clinic -
- dokonywane są duże inwestycje w badania i rozwój bez zwrotu z inwestycji
- Wydajność procesu - proaktywnie rozważ skalowanie, a nie tylko początkową szybkość
- Strategia składania wniosków - zidentyfikuj i skontroluj, czy lek jest gotowy do wprowadzenia do obrotu./b> - zidentyfikuj kraj, w którym należy złożyć wniosek w pierwszej kolejności i szybko uzyskaj dostęp do rynku
Dostęp do odpowiednich zasobów pomaga skupić się na odkryciach o największym potencjale pomocy potrzebującym pacjentom. Wybierz swój etap procesu rozwoju, aby dowiedzieć się więcej lub skorzystaj z linków do produktów i usług, aby znaleźć zasoby.
Przepływ pracy zasobów Biotech Hub


Odkrycie
Identyfikacja czynników, zasobów i wsparcia potrzebnych do opracowania nowego kandydata na lek biologiczny

Faza I-II
Przyspieszenie opracowywania procesów dzięki wskazówkom, szablonom i przewodnikom po aplikacjach

Faza III i produkcja
Postęp od skalowania i transferu technologii do produkcji wysokiej jakości do testów i komercjalizacji

Programy startowe
Połączenie z zasobami i programami grantowymi, które mogą uwolnić potencjał twojej cząsteczki

Regulacyjne
Poruszanie się po jednej z najbardziej regulowanych branż na świecie zaczyna się od zaufanego przewodnika
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?



