バイオセンシング向け磁性ナノ粒子の合成
Riddhiman Medhi, Pannaree Srinoi, Tingting Liu, Hung-Vu Tran, Maria D. Marquez, T. Randall Lee
Department of Chemistry and the Texas Center for Superconductivity, University of Houston
Material Matters, 2020, Vol.14 No.4

図1バイオセンシングのための磁性ナノ粒子:技術、磁化に影響する要因および磁性ナノ粒子合成法
通常、磁性ナノ粒子は、固有の磁気双極子と外部磁場の存在の有無に応じた正味の磁化に基づいて、反磁性、常磁性、強磁性、フェリ磁性、反強磁性および超常磁性に分類されます2。外部磁場が存在する場合、磁性ナノ粒子の配向が外部磁場の方向に沿って整列したときに観測される最大磁化が飽和磁化(Ms)として定義されます4。外部磁場を取り除いたとき、磁性ナノ粒子の磁気モーメントはそれまでの配向および磁化を維持し、これが残留磁化(Mr)として定義されます。一般にMs値が大きな磁性ナノ粒子は感度が高く、センシング効率が向上するため、バイオセンシング用途に適しています5。さらに、Ms値は一般に磁性ナノ粒子のサイズとともに増加します。形状に関する明確な見解の一致はありませんが、一部の報告では、立方体の磁性ナノ粒子は球状の磁性ナノ粒子より結晶性が高いため、バイオセンシング能力が高いと結論されています2。
特定のバイオセンシング用途に向けて磁性ナノ粒子を設計する際、適切なサイズと形状の特定、生体適合性リガンドによる磁性ナノ粒子の修飾、磁気特性の最適化および磁性ナノ粒子の有効性を評価するための適切な磁気検出技術の見極めなど、複数の要素を考慮する必要があります。酸化鉄ナノ粒子(IONP:iron oxide nanoparticle)は、生体適合性、低毒性、強い超常磁性、良好な触媒活性および単純な調製プロセスが活かされ、バイオセンシングにおいて最も一般的に使用されている金属酸化物磁性ナノ粒子の1つです1,4。ただし、市販の磁性ナノ粒子、特に酸化鉄ナノ粒子は磁力が弱いため、磁気検出の感度が制限されます。したがって、高感度センサの開発のために固有の磁気および電気特性を最適化する目的で、サイズおよび形状をよく制御した酸化鉄ナノ粒子の設計および合成が追究されています。最も一般的に使用されている酸化鉄ナノ粒子の合成法は、共沈殿、熱分解、水熱法などの湿式化学の方法です4。バイオセンシング用途において形状が磁気特性に及ぼす効果を研究するため、サイズおよび形状を制御可能な酸化鉄ナノ粒子の新しい合成法を探索するさまざまな研究が続けられています。本稿では、均一なFe3O4ナノスフェアおよびナノキューブを得るために使用される合成手順を評価します。また、酸化鉄ナノ粒子系バイオセンサの選択性および感度に対する形状、サイズおよび第二の金属(Fe3O4系二元金属磁性ナノ粒子など)の効果についても議論します。
酸化鉄ナノスフェア
ナノスフェア6、ナノキューブ6、ナノロッド7、ナノワイヤ8、ナノプレート9などの多様なFe3O4ナノ構造が報告されており、幅広い用途で使用されています。非球状のFe3O4ナノ構造の場合、主にオレイン酸ナトリウムやメチルトリオクチルアンモニウムブロミドなどの界面活性剤を混合することで形状が制御されます9。直径が100 nmを超えるFe3O4ナノスフェアの場合、最終的な粒子サイズまで凝集するナノ結晶の集合から粒子が成長します10。大きな酸化鉄ナノ粒子(直径 > 100 nm)を得るために、水熱ポリオール法が非常に有効であることが示されています。エチレングリコール(EG:ethylene glycol)およびジエチレングリコール(DEG:diethylene glycol)は、大きく均一な酸化鉄ナノ粒子の合成に使用される2つの一般的なポリオールです6,11。最近、Kolhatkarらは、ポリオールとしてEG、鉄の供給源として塩化鉄六水和物を使用した水熱ポリオール法で得られた直径100 nm~300 nmの一連の球状酸化鉄ナノ粒子の合成について報告しています6。反応時間、温度および撹拌速度を変え、これらの酸化鉄ナノ粒子を調製しました。同様に、Chenらは、図2に示すように、120 nm、440 nmおよび700 nmというさらに広いサイズ分布の一連の酸化鉄ナノ粒子を報告しています11。200 nmより小さい酸化鉄ナノ粒子の場合、120 nmの酸化鉄ナノ粒子の調製に還元剤および溶媒(EGおよびDEG)が不可欠であることを示しています。また、酸化鉄ナノ粒子の目標サイズが200 nmを超える場合、DEGの存在下で凝集中心の数が増加すると述べています。さらに、EGにはより強い還元能力とより広いサイズ制御能力があります。最終的に、酸化鉄ナノ粒子のサイズは、反応温度、圧力、時間、濃度、撹拌速度、還元剤および溶媒などの多数の要因に影響される可能性があります6,11。
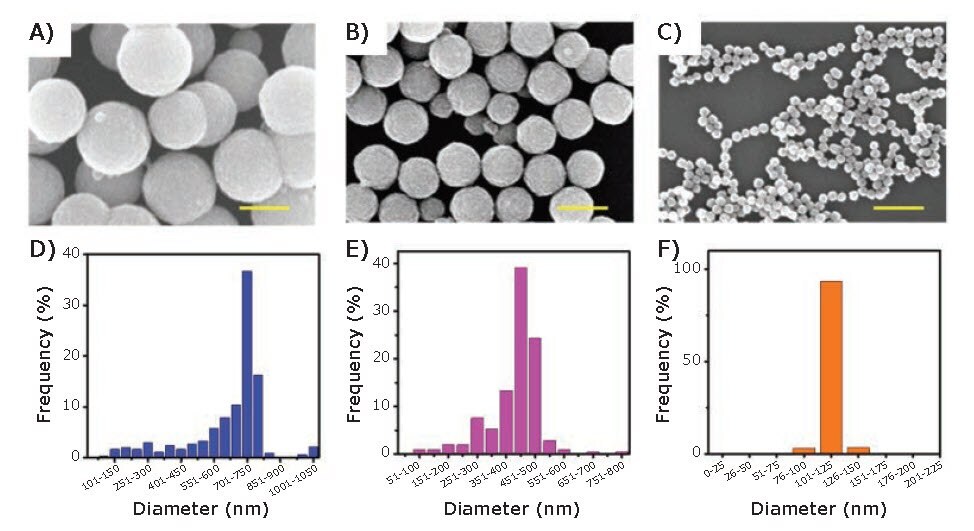
図2それぞれ直径700、440および120 nmの酸化鉄ナノ粒子のSEM像およびサイズ分布。スケールバー:500 nm。許可を得て文献11より転載(copyright 2018 American Chemical Society)。
より小さい(< 30 nm)球状酸化鉄ナノ粒子の調製には、共沈殿、熱分解および水熱法が一般的に使用されます10。より大きい酸化鉄ナノ粒子の場合と同様に、鉄の供給源、反応温度に加えて溶液のpHを調整することで、粒子サイズを制御することができます10。共沈殿法は、30 nmより小さな酸化鉄ナノ粒子を得るために最も有効な方法の1つと考えられています。ただし、熱分解法や水熱法でも優れた結晶子の形状をもつ酸化鉄ナノ粒子(< 30 nm)を得ることが可能です10。具体的には、熱分解法では沸点の高い有機溶媒と安定剤が必要とされ、水熱法では高圧下(> 2000 psi)および高温(> 200℃)で反応させる必要があります10。
酸化鉄ナノキューブ
均一な酸化鉄ナノキューブ(IONC:iron oxide nanocube)の合成においてよく利用される2つの経路があります。その1つは、鉄(III)アセチルアセトナートとオレイン酸およびベンジルエーテルを併用する方法です。この方法は2007年にYangら12によって最初に用いられ、Fe(acac)3、1,2-ヘキサデカンジオール、オレイン酸、オレイルアミンおよびベンジルエーテルの混合物を使用して、単結晶のマグネタイト相Fe3O4ナノキューブ(一辺の長さが15 nm)が合成されています。この方法で得られた酸化鉄ナノ粒子を図3Aに示します。この合成では、上記の混合物を流通Ar下で1時間、110℃に加熱した後、温度を200℃まで上げて30分間維持し、さらに加熱速度15℃/分で還流温度の約290℃まで反応を加熱し、1時間還流します。エタノールを加えてナノキューブを沈殿させ、トルエンとヘキサンの混合溶媒に再分散させます。この方法には少なくとも2つの明らかな利点があります。第一に、ワンポット法であり、種結晶媒介成長法と比較して容易です。第二に、単に加熱パラメータを変えるだけでナノキューブのサイズを調整できます。例えば、速度35℃/分で還流温度を急速に上げて還流時間を20分に短縮すると、相対的に核生成が速くなるため、より小さいナノキューブ(一辺の長さが6.5 nmなど)が得られます。より大きいナノキューブ(一辺の長さが30 nmなど)は、加速速度を5℃/分、還流時間を3時間に延長し、核生成を遅くすることで得られます。
Kimらはこの手順を簡略化して、図3Bおよび3Cに示すように、一辺の長さが79 nm、110 nmおよび160 nmのさらに大きいナノキューブを合成しています13。79 nmのキューブの場合、Fe(acac)3、オレイン酸およびベンジルエーテルの脱ガスした混合物を、20℃/分で290℃まで加熱し、この温度で30分間維持しました。冷却後、この溶液にトルエンとヘキサンを加え、粒子を沈殿させました。ベンジルエーテルの量を減らすと一辺の長さが110 nmの切頂立法体が得られました。また、反応時間を1.5時間から2時間に延長すると、一辺の長さが160 nmの立方体が得られました。

図3エーテルを使用した還流法を用いて合成された酸化鉄ナノ粒子のTEM像。A)Yangらによる。許可を得て文献12より転載(copyright 2008 AIP Publishing)。B、C)Kimらによる。許可を得て文献13より転載(copyright 2008 American Chemical Society)。
ナノキューブは、[111]方向に沿った速い成長により形成され、ナノキューブの投影面は(100)面になります。さらに、作製法を少し変更して4-ビフェニルカルボン酸と少し多くオレイン酸を加えると一辺の長さが22 nmのナノキューブが得られ、さまざまなサイズ(大小両方)のナノキューブを作製する多用途性も示されています13。これを踏まえて、多くの研究で修正された方法により、さまざまな酸化鉄ナノ粒子が得られています6,14。Kolhatkarらは、Fe(acac)3とオレイン酸を使用してベンジルエーテル中で290℃に加熱することで、この方法をさらに簡略化しています6。この研究者らは、反応物濃度と反応時間を変えることで、図4に示すように、対角距離が135、150、175および225 nm(一辺の長さがそれぞれ80、85、100、および130 nm)のさらに大きいFe3O4ナノキューブを得ています。別の研究では、この方法を酢酸マグネシウム支援に変更し、加熱温度を低減することでもナノキューブの合成に成功しています。オレイン酸ナトリウム濃度を調整することで、一辺の長さが22 nm、36 nmおよび57 nmのナノキューブが10%未満のサイズ偏差で得られています15。

図4Kolhatkarらにより合成された酸化鉄ナノ粒子のSEM像およびそれぞれのサイズ分布プロット。許可を得て文献6より転載(copyright 2017 American Chemical Society)
別の方法では、鉄の供給源にフェロセンを使用して、一辺の長さが約70 nmの酸化鉄ナノ粒子が合成されています16。この方法では、フェロセンとポリビニルピロリドンを水およびアルコールに溶解させた後、過酸化水素をゆっくりと加えます。次に、混合物をテフロンで内張りしたステンレスオートクレーブに移動して230℃のオーブンに24時間入れた後、室温まで自然冷却しました。注意すべき点として、この方法では立方体に加えて多面体の粒子が若干生成します。それでも、エーテルを使用する還流法は、立方体ナノ粒子作製の容易さと信頼性のため、Fe3O4ナノキューブのより好ましい合成法として複数の研究グループで引き続き採用されています6,14,15。
磁性バイオセンシングにおける応用
バイオセンシングツールとしての磁性ナノ粒子は、さまざまな磁気検出技術を必要とします。これらの技術は、容積測定と表面に基づく技術の2種類に分類することができます。平面ホール効果(PHE:planar Hall effect)および核磁気共鳴(NMR:nuclear magnetic resonance)システムなどの容積測定に基づくセンサは、単純で迅速にサンプルを調製し、検出します。一方、巨大磁気抵抗(GMR:giant magnetoresistance)およびトンネル磁気抵抗(TMR:tunnel magnetoresistance)センサなどの表面に基づくセンサは、検出限界が極めて低いものの、サンプル調製に労力を要します。さらに、超伝導量子干渉計(SQUID:superconducting quantum interference device)および原子磁力計(AM:atomic magnetometer)は、目的用途に応じていずれの手法でも動作させる高感度の装置です4。これらのバイオセンシング法は材料の磁気特性に依存し、磁気特性は粒子のサイズ、形状および組成などの要素を変えることで調整が可能です2。以下、磁性ナノ粒子の磁気特性および最終的にはこれらのナノ材料のセンシング能力に対するサイズ、形状および組成の効果に議論の焦点を合わせます。
最近、Chenらにより、粒子サイズとバイオセンサにおける磁性ナノ粒子の性能の関係が調べられています11。特にChenらは直径が120、440および700 nmの磁性酸化鉄粒子を合成し、特異的かつ高感度のタンパク質検出に使用するため、その表面をストレプトアビジンで修飾しました。磁性ナノ粒子の生体機能化は、最初にシリカ被覆を行い(オルトケイ酸テトラエチルから)、次に3-(トリメトキシシリル)プロピルメタクリラートから生成するカルボキシ末端ポリマーを成長させ、最後にストレプトアビジンのペンダントアミノ基とのカルボジイミドカップリングを行うことで達成されました。
磁気信号および応答は粒子サイズの増加とともに大幅に向上し、市販のDynabeadsを上回りました。概念実証として、受容体上の磁気的に標識されたタンパク質(IgG1)との置換による溶液中の標的化タンパク質(IgG2a)の特異的検出において、これらの修飾磁性粒子が試験的に用いられました。この場合、表面固定化受容体に対するタンパク質の結合親和性の差異(すなわち、IgG2aの結合親和性がIgG1より高いこと)が置換を促進します。これらの高感度で特異的な標識フリーのタンパク質検出実験は、力誘起残留磁化分光法(FIRMS:force-induced remnant magnetization spectroscopy)から派生した、交換誘起残留磁化法(EXIRM:exchange-induced remnant magnetization)を用いて行われました17。合成された磁性ナノ粒子は、市販のDynabeadsと比較して、700、400および100 nmの磁性粒子についてそれぞれ9倍、4倍および2倍の感度向上を示しました。
また、Kolhatkarらは、酸化鉄ナノ粒子の形状とその磁気センシング能力の関係も調べています6。具体的には、体積または寸法(すなわち対角距離または直径)のいずれかが等しい粒子を得るため、サイズ調整可能なFe3O4ナノキューブとナノスフェアが合成されました。これらの磁性ナノ粒子の磁気特性は、振動試料型磁気測定(VSM:vibrating sample magnetometry)によって評価され、ナノスフェアと同体積および同対角距離/直径基準で比較し、ナノキューブではMsおよび保磁力がそれぞれ1.4~3倍および1.1~8.4倍高いことが明らかになりました。X線回折(XRD:X-ray diffraction)および透過型電子顕微鏡(TEM:transmission electron microscopy)により、ナノキューブはナノスフェアより結晶性が高く、ナノスフェアが多結晶であるのに対して、ナノキューブは主に単結晶として成長することが示されました(図5A)。したがって、対応するナノスフェアと比較した場合、ナノキューブの高い結晶性が、高いMsおよび高いキュリー温度をもたらしています。さらに、合成された磁性ナノ粒子のセンシング能力が、GMRセンシングおよびFIRMによって評価されました。両方の手法において、ナノスフェアと比較した場合、ナノキューブの感度に明確な利点があることが明らかになりました。この結果は、ナノキューブの強い磁化および結合親和性により説明されています(図5B)。
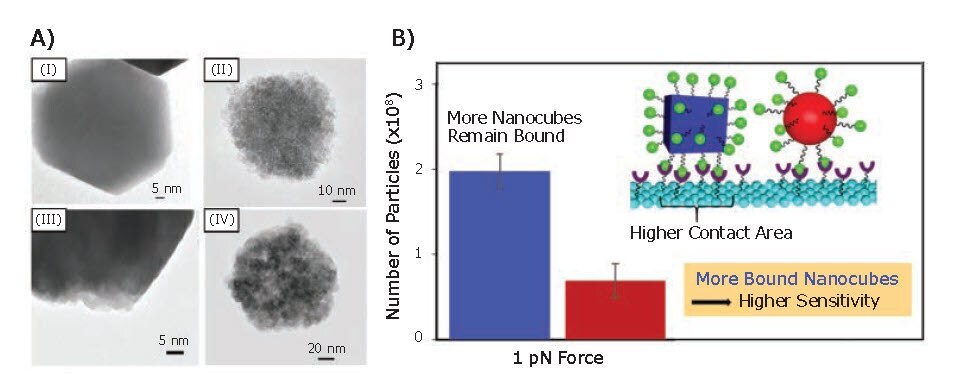
図5Fe3O4ナノキューブおよびナノスフェアの磁性センシング能力。A)(I) 150 nm立方Fe3O4磁性ナノ粒子、(II) 100 nm球状Fe3O4磁性ナノ粒子、(III) 135 nm立方Fe3O4磁性ナノ粒子、および(IV) 135 nm球状Fe3O4磁性ナノ粒子のTEM像。B)球状磁性ナノ粒子(赤)と比較した立方磁性ナノ粒子(青)の1 pNにおけるセンサ上の粒子数および接触面。許可を得て文献6より転載(Copyright 2017 American Chemical Society)。
単一成分の磁性ナノ粒子に加えて、磁性二元金属ナノ粒子もバイオセンシング材料として使用されています18。単一成分のナノ粒子と比較して、これらのナノ粒子は典型的に大きな磁気モーメントを示します。その結果、二元金属ナノ粒子は、通常、単一成分の磁性ナノ粒子より感度を向上させます。ただし、単一成分の酸化鉄ナノ粒子と同様に、粒子の組成および構造の変化が磁気応答に影響します。例えば、Kolhatkarらは、立方シリカ被覆FeCo磁性ナノ粒子の合成と研究を行い、粒子サイズを体系的に増加させると、それに応じて磁気信号および応答が増加することを示しています19。
結論
磁性ナノ粒子を使用した高感度のバイオセンサを作製するためには、強い磁気応答を示す磁性ナノ粒子の利用可能性が鍵になります。本稿で示したように、センサの応答は単に磁性ナノ粒子のサイズおよび形状を調整するだけで向上させることができます。より大きな粒子の性能は小さな粒子の性能を上回り、結晶性の高い粒子(ナノキューブなど)の性能は結晶性が低い粒子(ナノスフェアなど)の性能を上回ります。狭いサイズ分布および大きな結晶子サイズで、球状または立方体のいずれかの形状の大型(> 100 nm)と小型(< 30 nm)の両方の磁性ナノ粒子を得るために、さまざまな合成方法が開発されています。さらに、最近実証されている酸化鉄ナノ粒子がin situで非磁性の生成物に変化する「信号損失」のアプローチ20のように、新しい磁性ナノ粒子のさらなる開発が、磁性ナノ粒子を使用したセンシングの新しいアプローチにつながる可能性があります。
謝辞
This research was generously supported by the Robert A. Welch Foundation (Grant No. E-1320), the Air Force Office of Scientific Research (AFOSR FA9550-18-1-0094), and the Texas Center for Superconductivity at the University of Houston.
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?