一般的な取扱いガイドライン
神経突起伸長に関する解析プロトコル
細胞浸潤アッセイプロトコル
血管新生時の管腔形成プロトコル
多能性幹細胞培養プロトコル
よくある質問
基底膜は細胞外タンパク質とグリコサミノグリカンから成る薄い層であり、上皮とその下の組織を分けているとともに、上皮を支える結合組織と上皮をつなぐ機能を果たしています。基底膜抽出物(BME)は未処理のECM混合物であり、ラミニン、IV型コラーゲン、エンタクチン、ヘパラン硫酸プロテオグリカンなどを含み、ECMを豊富に含むマウスEngelbreth-Holm-Swarm(EHS)肉腫から分離されます。BMEは、さまざまな種類の細胞に対するコーティング基質を供給し、組織内でみられる自然なECM環境を再現します。ECMゲルとは、EHS肉腫の基底膜から分離される生物学的3Dハイドロゲルです。製品は20~40℃で重合反応が活性化されると、再構成された基底膜を形成します。ECMゲルは、上皮細胞、内皮細胞、筋細胞、神経細胞、腫瘍細胞、幹細胞などの多様な細胞において、細胞接着、神経突起伸長、細胞浸潤、細胞遊走、血管新生時の管腔形成などに対するin vitro解析に対応します。これまでに1000件を超える文献で引用されており、標準フォーマット(E1270)と成長因子低減フォーマット(E6909)の2タイプが各種容量で販売されています。成長因子低減ECMゲルでは、通常のECMゲルと比較して、bFGF、EGF、IGF-1、TGF-β、PDGFおよびNGFの各サイトカイン量が低くなります。

図1.基底膜の構造基底膜は、ECMタンパク質(コラーゲン、ラミニン、フィブロネクチン)とグリコサミノグリカンの複雑な混合物から成り、基底膜の下にある結合組織と上皮を分けています。ECMゲルマトリックスは、ECMタンパク質を豊富に含むEHS腫瘍から分離されたBMEです。
一般的な取扱いガイドライン
- ECMゲルは温度変化に敏感です。温度の上昇はゲル内の重合反応を起こし、通常5~10分程度でゲルを急速に固めます。凍結されたECMゲルは2~8℃で一晩かけて解凍するとともに、使用時は常に氷上に静置してください。マルチウェルプレートにゲルを分注する際には、予め2~8℃に冷却したピペット、プレート、培地などを使用し、重合を防いでください。
- ECMゲルは、(2~8℃に)冷却したダルベッコ改変イーグル培地を用いて2倍まで希釈することが可能です。低温にもかかわらずゲルがゼラチン状である場合には、粘度を下げるために希釈が有用となる場合があります。希釈する場合は、プレートにゲルを加える前に実施してください。操作が長時間におよぶ場合には10℃未満で作業を行う必要があるため、氷上で作業を行います。
- 細胞は薄いゲル層(0.5 mm厚)の上に播種する、あるいは1 mm厚のゲル層内部で培養することが可能です。後者の場合、プレートなどに載せる前に予め細胞をゲルに加えてください。この際の細胞の密度は、ゲル1 mL当たり3~4×104個とすることを推奨します。
- 細胞をゲルから分離する場合は、カルシウム、マグネシウムおよびEDTAを含まないPBSに1 mL当たり0.6~2.4ユニットのディスパーゼ(D4818)を加えたものを用いてください。
神経突起伸長に関する解析プロトコル
- PC12細胞(88022401)をはじめとした神経細胞は、実験開始前に対数増殖期に入っており、70~80%コンフルエントに達していること
- 冷却されたECMゲル(E1270、E6909)500 µLをピペットでウェルに入れるその際、数個のウェルにはECMゲルを入れずにブランクコントロールとすること
- ゲル化のため、温度37℃、CO2濃度5%のインキュベーターに5~30分間置く
- 培地を吸引除去する
- 滅菌PBS(D8527)15 mLで細胞を2回洗浄する
- トリプシン-EDTA溶液(T4049)1 mLに細胞を1分間インキュベーションする
- 細胞が球状になり剥離が始まったら、培地10 mL中に捕集して浮遊させる
- 培地中の細胞密度を顕微鏡下で血球計にて計測するその後、細胞懸濁液中の細胞密度が1 mL当たり2~3×105個になるよう、培地で希釈する
- ECMゲルでコーティングされたウェル1つにつき、1 mLのPC12細胞懸濁液を加える
- 37℃、CO2濃度5%で24~48時間培養する
- ECMゲル上で培養されたPC12細胞群では、3次元的に複雑な神経回路網を形成した神経突起の伸長が広範でみられます。これらは倒立顕微鏡で観察が可能です(図2B、C)。ECMゲルがない状態で培養されたPC12細胞の形態には変化がなく、神経突起はみられません(図2A)。

図2.ECMゲルマトリックスを用いたラットPC12神経細胞の神経突起伸長A)通常のPC12細胞(88022401)を、ECMゲルのコーティングがないプラスチック容器で培養した場合の形態。BおよびC)ECMゲルマトリックス上で培養したPC12細胞では、24~48時間後、複雑な神経回路網が3次元的に形成された神経突起を認めます。
細胞浸潤アッセイプロトコル
- 4℃でECMゲル(E1270、E6909)を一晩解凍し、氷上に静置する
- Millicell®インサートとプレートを4℃に冷却し、氷上に静置する
- ECMゲルを氷冷したDMEMで希釈し、最終的な濃度を2 mg/mLとする(ECMゲル濃度の詳細は、製品ラベルおよび試験成績書を参照のこと)
- ミリセルインサートの上部区画にECMゲル100 µLを加える
- ゲルを固めるため、直ちにプレートを37℃で2時間静置する
- 細胞を1×PBS(D8527)で洗浄し、トリプシン-EDTA溶液(T4049)を用いて細胞を剥離する
- 細胞を2回DMEMで洗浄した後、5×105個/mLの密度で再度浮遊させる
- プレートの下部区画に10%FBS(F2242)入りDMEMを加えるプレートの推奨分量を用いるゲルで満たされたインサートを培地に浸漬した状態になるようにウェル内に設置する
- 1×105個の細胞をインサート上部区画に加える
- プレートを37℃で24時間インキュベートする
- 培養後、注意しながらインサートを取り出す上部区画内の細胞を綿棒で取り除く
- 5%グルタルアルデヒド(G5882)でインサート下側の細胞を10分間かけて固定し、2%エタノール溶液に1%クリスタルバイオレット溶液(V5265)を加えたもので20分間染色する
- 水(W3500)で3~4秒間洗浄し、余分な染料を除去する
- インサートを完全に乾燥する
- インサート下側の細胞数を計測する、あるいは染料を抽出したうえで分光光度計にて細胞浸潤を定量化する
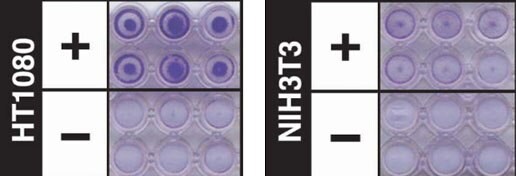
図3.ECMゲルマトリックスを用いた細胞浸潤アッセイ96穴細胞浸潤解析キット(ECM550)により、ECMゲルコーティングを施されたミリセルインサートを用いてHT-1080細胞(85111505)浸潤を解析した様子浸潤細胞は、クリスタルバイオレット染色(写真中で紫色)によって可視化しました。非浸潤性の対照としてNIH3T3細胞(93061524)を用いました。
血管新生時の管腔形成プロトコル
- ヒト臍帯静脈内皮細胞(HUVEC)は、実験を始める前に対数増殖期に入っており、70~80%コンフルエントに達していること
- 管腔形成解析に先立ち、HUVECを3~6時間無血清状態にしておく
- ECMゲル(E1270、E6909)を4℃で一晩かけて解凍し、実験中は常に氷上に置いておく
- 96穴プレートのすべてのウェルに、解凍したECMゲルを100 µLずつ入れる
- ゲルを固めるため、直ちにプレートを37℃で2時間静置する
- トリプシン-EDTA溶液(T4049)を用いて飢餓状態のHUVECを剥がした後、FBS(F2242)を加えて飢餓状態を解消するHUVECをペレット化して、HUVEC培地中で再度浮遊させる
- HUVEC培地中でHUVECを4×105個/mLの密度で再度浮遊させる
- 96穴プレートのすべてのウェルに、細胞懸濁液を100 µLずつ入れる(ウェル1つ当たりの細胞数は4×104個)
- プレートを37℃、CO2濃度5%条件下に置き、4~6時間細胞を培養する
- 細胞を光学顕微鏡下で観察する血管新生を定量化するには、形成された毛細管の数をカウントし、血管網の複雑性を分析したうえで形成された毛細管の長さを測定する

図4.ECMゲルマトリックスを用いた血管新生の際の管腔形成HUVECは、血管新生の誘導後にカルセイン-AM(17783)によって緑色に染色した
多能性幹細胞培養プロトコル
ヒト多能性幹細胞(ES細胞およびiPS細胞)を増殖させるには、認証済みのECMタンパク質でコーティングされた培養器具が必要です。 以下に、幹細胞実験用認証ECMゲルマトリックス(CC131)を用いた6穴プレートのコーティングに関する一般ガイドラインを示します。 いずれの手順とも、安全キャビネット内において無菌下に実施しなければなりません。
- 使用前日に、ECMゲルマトリックス(CC131)を2~8℃の冷蔵庫で解凍する解凍後は、ECMゲルを常に氷上で保管し、予め冷却してある培地やピペットを用いることでゲル凝固を防ぐこと
- ECMゲルマトリックス(CC131)を、冷却されたDMEM-F12(D6421)培地で1:80に希釈する 必要な分量に応じて希釈濃度を濃い目または薄目に調整してもよい 以下は、1:80希釈ECMゲル1.5 mLによる6穴プレートコーティングの例である
まず、1:20希釈液を調製するために、15 mLコニカルチューブにECMゲル0.5 mL、および冷却したDMEM-F12培地またはDMEM培地9.5 mLを加える (総量10 mL)
最終的に必要な1:80希釈を得るためには、さらに4倍に薄めなければならないため、 冷却したDMEM-F12培地7.5 mLに1:20希釈ECMゲル2.5 mLを加える(総量10 mL)
注記推奨希釈比は1:80。ただし、必要に応じて、さらに高濃度の幹細胞実験検証済みのECMゲルマトリックスを用いてもよい - 1:80希釈ECMゲルマトリックス(CC131)のうち、1.5 mL分を6穴プレートの各ウェルに入れる プレートを回しながら、ECMゲルマトリックスをプレート表面に均一に広げる この後、プレートを2~8℃の冷蔵庫で一晩保管する。最短でも使用前に2時間は冷蔵すること すぐに使用しない場合は、ECMコーティングが施された培養プレートをパラフィルムで覆う。使用するまで2~8℃で保管可能であるが、3~4日以内に使用すること
- 細胞播種前にプレートを10~15分間かけて室温に戻し、コーティング溶液を除去したうえで、ウェル1つにつき3 mLのヒトES細胞またはiPS細胞増殖用培地(SCM130)を加える以上で、新たにコーティングされたプレート上に細胞が播種できる
重要: プレートを乾燥させないこと

図5.血清を含まない培地で培養されたPBMC-由来ヒトiPS細胞について、幹細胞実験検証済みのECMゲルマトリックス(A)またはマトリゲル(B)上で培養した際の5代にわたる継代培養後にみられる増殖の様態。ECMゲル上で培養されたiPS細胞の多能性に関連した形態を分析すると、マトリゲル上で培養した場合と同様の形態となった。PBMC-由来ヒトiPS細胞につき、幹細胞実験検証済みのECMゲルマトリックス上で培養した場合と、マトリゲル上で培養した場合での細胞の成長を比較するために、7代にわたり、継代培養細胞数をカウントしたところ、いずれも同様の傾向を示した(C)。
よくある質問
ECMゲルはライセート由来ですか、それとも実際の細胞基質由来の製品ですか。
ECMゲルはEHS肉腫そのものから作製されています(分離された細胞由来ではありません)。全摘出した肉腫に由来する製品です。
製品は、Matrigel®(コーニング社)、Geltrex®(サーモ社)、Cultrex®(トレビゲン社)などと同じものですか。
ECMゲルはこれらの製品と同等製品であり、メルク社が製造しています。
ECMゲルに接着因子は添加されていますか。
製品E1270は、EHSマウス肉腫から抽出されており、外因性の添加物は含まれていません。
ECMゲルの構成成分はどのようなものでしょうか。
基底膜の主たる構成成分は、ラミニン、IV型コラーゲン、エンタクチンおよびヘパラン硫酸プロテオグリカン(HSPG)です。このうち、ラミニン、IV型コラーゲンおよびエンタクチンについては概ね等モル量で存在しますが、HSPGに関してはこれらに比べると少なくなります。ただし、ECMゲルは生物学的抽出物であるため、構成成分濃度を厳密に示すことは不可能となります。
ECMゲル中のカルシウム濃度はどのくらいですか。
ECM溶液中のCaCl2濃度は、約0.265 mg/mLです。
ECMゲルには抗生剤は含まれていますか。
私たちのECMゲルには、ゲンタマイシンが添加されています。
ピルビン酸ナトリウム非含有のDMEMに入ったE1270を購入することは可能でしょうか。
E1270の製造に用いているDMEMはピルビン酸ナトリウムを含みません。
ECMゲルはマウスレトロウイルス検査済みですか。
製品E1270についてはウイルス検査を実施しておりません。しかし、これまでにいくつかの製品ロットでウイルス検査を実施した結果、乳酸脱水素酵素上昇ウイルス(LDEV)フリーであることがわかっています。また、メルクに原料を供給するハーラン社は自社のSPF試験にLDEV検査を追加しており、由来動物(マウス)はこのウイルスに感染していないことが確認されています。さらに、リスクアセスメント結果より、製造プロセス後においてもRNAウイルスが生存することはできないことがわかっています。したがって、私たちの製品はLDEVフリーであると考えられます。
ECMゲルを解凍後に再凍結した場合であっても、3次元細胞培養で適切なパフォーマンスが得られますか。
ECMゲルを解凍後に再凍結することは推奨できません。その代わりに、ゲルをプレートに流し込んだうえで、2~8℃で保存することは可能です。その場合、ゲルの乾燥やひび割れを防ぐためにしっかりと密閉した状態で保存してください。
E1270のデータシートによれば2倍まで希釈可能であると書いてありますが、これはどのような意味ですか。
ECMゲルは、ダルベッコ改変イーグル培地(DMEM)によって2倍希釈することが可能です。つまり、ECMゲルを等量の冷却DMEMで薄めることができます。
ゲルは細胞の存在下で劣化しますか。
細胞とともに7日間培養しても劣化しないことが知られています。
どのようにすればECMゲルから細胞を回収できますか。
ディスパーゼ(D4818)はバシラス属菌類由来の中性プロテアーゼであり、ECMゲル中で培養された細胞の回収に推奨されています。(製品番号E1270)。ディスパーゼは、トリプシンやコラゲナーゼなどといった他のタンパク分解性酵素に比べてきわめて効率的に単一細胞を捕集することが可能です。また、ディスパーゼは穏やかに作用するため、継代培養や他の研究用に回収した細胞に損傷を与えることもありません。
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?