おすすめの製品
タイプ
Type VIII
品質水準
フォーム
lyophilized powder
比活性
10-20 units/mg protein (using 4MU-NANA)
3.5-8.0 units/mg protein (mucin)
組成
Protein, ≥85% biuret
その他の活性
Protease and NAN-aldolase, present
保管温度
−20°C
遺伝子情報
Clostridium perfringens str. 13 ... nanI(988807)
類似した製品をお探しですか? 訪問 製品比較ガイド
詳細
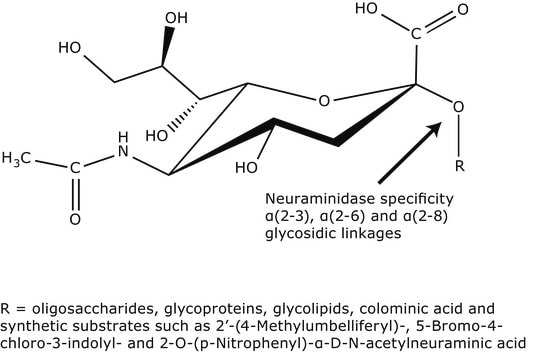
ノイラミニダーゼ酵素は、末端シアル酸残基の加水分解を触媒するグリコシドヒドロラーゼ酵素です。最もよく知られているのは、インフルエンザウイルスの放出を促進するウイルスノイラミニダーゼです。
アプリケーション
Clostridium perfringens(ウェルシュ菌)由来のノイラミニダーゼは、微少毒素の結合特性を蛍光活性化サイトメトリーにより評価する研究で使用されています。 また、食中毒を起こす分離株におけるノイラミニダーゼの分布を調べる研究にも使用されています。
生物化学的/生理学的作用
Clostridium perfringens(ウェルシュ菌)のノイラミニダーゼによる脂質単層で増えたガングリオシドの分解は、表面圧力に大きく依存します。圧力が上昇するとノイラミニダーゼ活性が阻害される場合があります。
ノイラミニダーゼによるシアル酸基の切断は、糖タンパク質構造の抗体による認識を調べる目的で使用されています。N-アセチルノイラミン酸の定量におけるノイラミニダーゼの使用は、他の 2 つの方法よりも良好でした。
ノイラミニダーゼは、様々な糖タンパク質から、末端の N-アセチルノイラミン酸(シアル酸)を切断するのに使用されます。 Clostridium perfringens 由来の本酵素は、Gal、GlcNac、GalNAc、AcNeu、GlcNeu、オリゴ糖、糖脂質、または糖タンパク質に、α-2,3-、α-2,6-、またはα-2,8-結合した末端のシアル酸残基を切断します。切断の相対速度は次の順に低下します:α-2-3 > α-2-6。α-2-8。C. perfringens由来ノイラミニダーゼは、α-2,6結合を好んで切断するA. ureafaciens由来ノイラミニダーゼ(Sigma N3642)と比べて、α-2,3結合のシアル酸残基を非常に効率よく切断します。
細胞表面の糖タンパク質から、シアル酸残基を除去するためにノイラミニダーゼを使用する例が、頻繁に報告されています。通常、ノイラミニダーゼを使用する手順は、PBS 中で 37°C、30 分間であり、その後、PBS で洗浄します。より低濃度のノイラミニダーゼによる組織切片の処理には、より長いインキュベーションが必要です:0.1 M 酢酸バッファー、pH 4.2 ~ 5 で、1 ~ 4 U/mL の場合、37°Cで 2 ~ 20 時間です。
単位の定義
1単位は、ウシ顎下腺ムチンから、37℃、pH5.0で1分間に1.0μMのN-アセチルノイラミン酸を遊離させます。
1単位は、pH5.0、37℃で1分間に2′-(4-メチルウンベリフェリル)-a-D-N-アクテチルノイラミン酸1.0μMを加水分解します(基質として4MU-NANAを使用)。
1単位は、pH5.0、37℃で1分間に2′-(4-メチルウンベリフェリル)-a-D-N-アクテチルノイラミン酸1.0μMを加水分解します(基質として4MU-NANAを使用)。
調製ノート
Type V(N 2876)をクロマトグラフィーにより精製
アナリシスノート
4MU-NANA 単位に基づくパッケージサイズ
シグナルワード
Danger
危険有害性情報
危険有害性の分類
Resp. Sens. 1
保管分類コード
11 - Combustible Solids
WGK
WGK 1
引火点(°F)
Not applicable
引火点(℃)
Not applicable
個人用保護具 (PPE)
Eyeshields, Gloves, type N95 (US)
適用法令
試験研究用途を考慮した関連法令を主に挙げております。化学物質以外については、一部の情報のみ提供しています。 製品を安全かつ合法的に使用することは、使用者の義務です。最新情報により修正される場合があります。WEBの反映には時間を要することがあるため、適宜SDSをご参照ください。
Jan Code
N5631-5UN-PW:
N5631-1UN-PW:
N5631-10UN-PW:
N5631-5UN:
N5631-VAR:
N5631-50UN-PW:
N5631-BULK:
N5631-50UN:
N5631-10UN:
N5631-1UN:
最新バージョンのいずれかを選択してください:
この製品を見ている人はこちらもチェック
B G Stiles et al.
Infection and immunity, 68(6), 3475-3484 (2000-05-19)
The binding characteristics of iota toxin, a binary enterotoxin produced by Clostridium perfringens type E, were studied by fluorescence-activated cytometry. The proteolytically activated binding component of iota toxin, iota b (Ib), bound to various cell types when incubated at 4
M A Perillo et al.
Biochimica et biophysica acta, 1193(1), 155-164 (1994-07-13)
The activity of Clostridium perfringens neuraminidase against gangliosides GM3, GD1a and GM1 was studied in lipid monolayers at the air-buffer solution interface. The enzyme activity assay against pure ganglioside monolayers is based on the markedly different molecular packing areas of
Distribution of Neuraminidase among Food-poisoning Strains of Clostridium perfringens
Moss, C.
Applied and Environmental Microbiology, 15, 718-722 (1967)
Gangliosides: structure, isolation, and analysis.
R W Ledeen et al.
Methods in enzymology, 83, 139-191 (1982-01-01)
A simple method for the purification of commercial neuraminidase preparations free from proteases.
M W Hatton et al.
Biochimica et biophysica acta, 327(1), 114-120 (1973-11-15)
ライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)