Produzione di vaccini a vettore virale
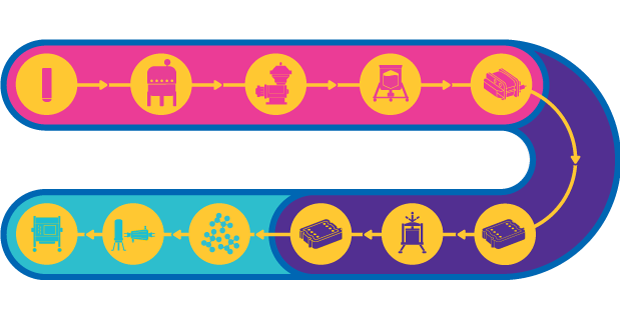
Fig 1:Sequenza del processo produttivo di vaccini a vettore virale
Un vaccino a vettore vivo utilizza un microrganismo attenuato o innocuo, ad esempio un adenovirus, per trasportare porzioni di un antigene al fine di stimolare una risposta immunitaria. I vaccini a vettore sono in grado di indurre una potente immunità cellulo-mediata essenziale nel caso di malattie complesse come, tra le altre, AIDS, malaria e cancro.
Benché il processo produttivo dei vettori sia piuttosto standardizzato, possono sorgere alcune difficoltà poiché per la produzione dei vaccini si possono utilizzare numerosi virus diversi con caratteristiche differenti. Per i vettori virali di grandi dimensioni un punto critico è la sterilità del processo a causa della perdita di resa associata alla filtrazione sterilizzante. Altre criticità sono l’aggregazione e la stabilità dei vettori.
Inoltre, molti processi in fase 1 e 2 prevedono l’impiego di colture cellulari adese, il che fa sì che il passaggio ai volumi propri della fase 3 e della produzione su scala commerciale richiedano aggiustamenti del processo per il raggiungimento degli obiettivi desiderati. Nelle ultime fasi, la resa e la purezza del prodotto sono essenziali perché nel prodotto finale è richiesto un titolo elevato.
Risorse correlate
Bioprocesso
Guida alle applicazioni biofarmaceutiche
Brochure: Vaccine Bioprocessing Handbook
Mini-manuale: Viral Vector Vaccine Bioprocessing
Webinar: Process Development Guidance for AAV and Lentivirus Manufacturing Based on Cost Modeling
Webinar: Sf-RVN Cell Line & CD Media Platform, A Production Platform for VLP and AAV
Libro bianco: Developing an Accelerated and More Cost-Effective Single-Use Adenoviral Vector Vaccine Manufacturing Process
Degradazione del DNA
Purificazione e chiarificazione
Articolo tecnico: Purificazione o rimozione di virus compresi i virus adeno-associati
Articolo: Robust Harvest Clarification For Adeno-Associated Viral Vectors Via Depth Filtration
Articolo: Clarification of vaccines: An overview of filter based technology trends and best practices
Articolo: Filter-Based Clarification of Viral Vaccines and Vectors Biosafety
Articolo: How to Ensure Biosafety Of Novel Viral Therapies
Raggiungi più velocemente la fase clinica e assicura uno scale-up affidabile
I processi upstream basati su colture cellulari per la produzione di vaccini a vettori virali devono essere ottimizzati al fine di soddisfare i requisiti di produttività. Questa ottimizzazione include anche la lisi cellulare e la chiarificazione, fasi essenziali per la rimozione delle cellule e dei frammenti cellulari e per assicurare una robusta raccolta di vettori. Tuttavia, il processo upstream può essere definito di successo soltanto se si presta a passaggi di scala affidabili che consentano di anticipare la domanda del mercato.
Raggiungi gli obiettivi di resa e di efficienza con un robusto processo di rimozione delle impurezze
Nei processi per la produzione di vaccini a vettore virale, tra i contaminanti più comuni troviamo gli acidi nucleici delle cellule lisate. Per i vaccini a virus attenuato, le norme richiedono che la contaminazione da carry-over di acidi nucleici delle cellule ospiti sia inferiore a 10 ng/dose. Il trattamento con l’endonucleasi Benzonase® seguito da filtrazione a flusso tangenziale è una combinazione robusta e potente per degradare e rimuovere gli acidi nucleici residui.
Massimizza il recupero nelle fasi downstream
I piccoli lotti tipici della fase clinica vengono solitamente purificati mediante ultracentrifugazione su gradiente di densità di CsCl, mentre la produzione su larga scala richiede due o tre fasi di purificazione cromatografica. Per la rimozione di DNA, RNA, proteine delle cellule ospiti e degli altri contaminanti più rilevanti solitamente si ricorre allo scambio anionico, mentre la cromatografia a esclusione dimensionale è utilizzata per la rimozione dei contaminanti in tracce.
Assicura la sicurezza dei pazienti
La filtrazione sterilizzante assicura la sterilità del prodotto finito e la sicurezza del paziente. Per eliminare i contaminanti microbici, è necessario un filtro con un grado di filtrazione minore o uguale a 0,22 µm. Un punto fondamentale di cui tener conto per il processo di filtrazione sterilizzante è il livello di aggregati virali. Queste formazioni devono essere controllate ottimizzando la formulazione, altrimenti la filtrazione sterilizzante può rivelarsi difficoltosa con il rischio di alte perdite di resa.
Trattamento con nucleasi e chiarifica
Assicura una robusta scalabilità.
- • Nuclease treatment with Benzonase® suitable for biopharmaceutical production EMPROVE® bio
- • Benzonase® Detection with Benzonase® Elisa Kit II to detect left over Benzonase® endonuclease in the process
- • Primary/Secondary Clarification with Millistak+® HC POD Depth Filters
- • Primary Clarification with Clarisolve® Depth Filters
- • Clarification Depth Filters & Pretreatment Solutions

Downstream - Filtrazione a flusso tangenziale
Raggiungi gli obiettivi di resa, efficienza e recupero di vettore, assicurando contemporaneamente una robusta rimozione delle impurezze
Cromatografia downstream
- • Membrane Chromatography with Natrix® Q Pilot Chromatography Membranes
- • Membrane Chromatography with Natrix® Q Recon Mini
- • Membrane Chromatography with Eshmuno® Q Resin
- • Affinity Chromatography with Fractogel® EMD DEAE Chromatography Resins
- • Affinity Chromatography with Fractogel® EMD DMAE Chromatography Resins

Prodotti chimici per il processo downstream e la formulazione

Tamponi e terreni liquidi per bioprocesso
Per sostenere al meglio le vostre produzioni biofarmaceutiche, disponiamo di una rete di infrastrutture per la produzione di soluzioni sterili della più alta qualità, in grado di fornire terreni di coltura pronti all’uso, tamponi, prodotti per CIP e per SIP provenienti da impianti GMP diffusi in tutto il mondo.
Filtrazione sterilizzante e riempimento finali
Garantisci la sicurezza dei pazienti con procedure di filtrazione sterilizzante affidabili e robuste.
· Filtrazione sterilizzante e riempimento finali
· Strategie di filtrazione sterilizzante
· Campionamento sterile con le soluzioni Novaseptum® Go
· Riempimento e finitura con le soluzioni monouso Mobius®

Per continuare a leggere, autenticati o crea un account.
Non hai un Account?


