T8658
Tripsina
suitable for protein sequencing, lyophilized powder
Sinonimo/i:
Porcine Trypsin, Trypsin for Mass Spectropetry
Autenticatiper visualizzare i prezzi riservati alla tua organizzazione & contrattuali
About This Item
Prodotti consigliati
Grado
Proteomics Grade
Stato
lyophilized powder
PM
23.8 kDa
Confezionamento
vial of 100 μg
Solubilità
hydrochloric acid: soluble 1 mM, clear
Compatibilità
suitable for protein sequencing
Temperatura di conservazione
−20°C
Cerchi prodotti simili? Visita Guida al confronto tra prodotti
Categorie correlate
Applicazioni
Per la digestione di peptidi con la tripsina, utilizzare un rapporto compreso all′incirca tra 1:100 e 1:20 per tripsina:peptide. L′impiego tipico di questo prodotto consiste nella rimozione delle cellule aderenti da una superficie di coltura. La concentrazione di tripsina necessaria per staccare le cellule dal relativo substrato dipende principalmente dal tipo di cellule e dall′età della coltura. Le tripsine sono state adoperate anche per la ri-sospensione delle cellule durante la coltura cellulare, nella ricerca proteomica per la digestione delle proteine e in varie digestioni in gel. Ulteriori applicazioni comprendono la valutazione della cristallizzazione con tecniche basate su membrana e l′impiego in uno studio per stabilire se i tassi e la resa del folding proteico possono essere limitati dalla presenza di trappole cinetiche.
- Trypsin from bovine pancreas has been used for in-gel digestion for MS (mass spectrometry) analysis.
- It has been used for the digestion of albumin for size-exclusion chromatography.
- It has been used for the digestion of HDL (high density lipoprotein) for LC-MS (liquid chromatography-mass spectrometry) analysis.
- It has been used for limited proteolysis of IST1 (putative MAPK-activating protein PM28).
Azioni biochim/fisiol
La tripsina scinde i peptidi sul lato C-terminale dei residui di lisina e arginina. La velocità di idrolisi di questa reazione viene rallentata se su uno dei lati del sito di scissione è presente un residuo acido. L′idrolisi si arresta se sul lato carbossile del sito di scissione è presente un residuo di prolina. Il pH ottimale per l′attività della tripsina è 7-9. La tripsina può anche scindere i legami esterei e ammidici dei derivati sintetici degli amminoacidi. L′EDTA viene aggiunto alle soluzioni di tripsina come agente chelante che neutralizza gli ioni di calcio e magnesio che oscurano i legami peptidici su cui agisce la tripsina. La rimozione di questi ioni aumenta l′attività enzimatica.
Gli inibitori delle serin proteasi, tra cui ad esempio DFP, TLCK, APMSF, AEBSEF e aprotinina, inibiscono la tripsina.
Gli inibitori delle serin proteasi, tra cui ad esempio DFP, TLCK, APMSF, AEBSEF e aprotinina, inibiscono la tripsina.
Componenti
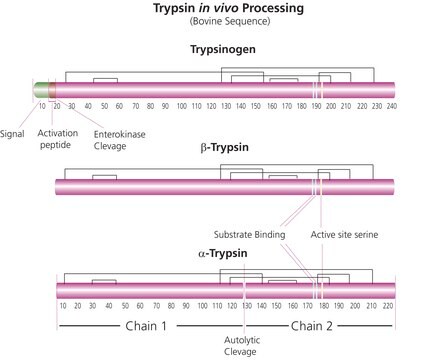
Trypsin consists of a single chain polypeptide of 223 amino acid residues, produced by the removal of the N-terminal hexapeptide from trypsinogen which is cleaved at the Lys - lle peptide bond. The sequence of amino acids is cross-linked by 6 disulfide bridges. This is the native form of trypsin, beta-trypsin. BETA-trypsin can be autolyzed, cleaving at the Lys - Ser residue, to produce alpha-trypsin. Trypsin is a member of the serine protease family.
Avvertenza
Solutions in 1 mM HCl are stable for 1 year in aliquots and stored at -20°C. The presence of Ca2+ will also diminish the self-autolysis of trypsin and maintain its stability in solution. Trypsin will also retain most of its activity in 2.0 M urea, 2.0 M guanidine HCl, or 0.1% (w/v) SDS.
Definizione di unità
Un′unità BAEE produce una A253 di 0,001 al minuto a pH 7,6 a 25°C usando il BAEE come substrato.
Nota sulla preparazione
This product is from pancreas sourced from New Zealand. It is soluble in 1 mM HCl at 1 mg/mL.
Inibitore
N° Catalogo
Descrizione
Determinazione del prezzo
Substrato
N° Catalogo
Descrizione
Determinazione del prezzo
Avvertenze
Danger
Indicazioni di pericolo
Consigli di prudenza
Classi di pericolo
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
Organi bersaglio
Respiratory system
Codice della classe di stoccaggio
11 - Combustible Solids
Classe di pericolosità dell'acqua (WGK)
WGK 1
Dispositivi di protezione individuale
dust mask type N95 (US), Eyeshields, Faceshields, Gloves
Scegli una delle versioni più recenti:
Possiedi già questo prodotto?
I documenti relativi ai prodotti acquistati recentemente sono disponibili nell’Archivio dei documenti.
I clienti hanno visto anche
D M Eckert et al.
Cell, 99(1), 103-115 (1999-10-16)
The HIV-1 gp41 protein promotes viral entry by mediating the fusion of viral and cellular membranes. A prominent pocket on the surface of a central trimeric coiled coil within gp41 was previously identified as a potential target for drugs that
Anthony G W Norden et al.
Kidney international, 66(5), 1994-2003 (2004-10-22)
Quantitative data on protein and polypeptide excretion in normal urine are lacking. In Fanconi syndrome, failure of proximal tubular protein reabsorption leads to 'tubular' proteinuria, but little is known about peptide excretion. Urine from normal (N=5) and Fanconi patients (Dent's
Conformational Changes in the Endosomal Sorting Complex Required for the Transport III Subunit Ist1 Lead to Distinct Modes of ATPase Vps4 Regulation.
Tan J, et al.
The Journal of Biological Chemistry, 290, 30053-30053 (2015)
Shanjin Huang et al.
The Journal of biological chemistry, 279(22), 23364-23375 (2004-03-25)
The cytoskeleton is a key regulator of plant morphogenesis, sexual reproduction, and cellular responses to extracellular stimuli. During the self-incompatibility response of Papaver rhoeas L. (field poppy) pollen, the actin filament network is rapidly depolymerized by a flood of cytosolic
J S Gilchrist et al.
The Journal of biological chemistry, 268(6), 4291-4299 (1993-02-25)
Recent evidence suggests that nuclei possess Ca2+ transport mechanisms to regulate nucleoplasmic/cytosolic Ca2+ gradients. We, therefore, investigated the possibility that Ca(2+)-binding proteins may also exist within the nucleus. Electrophoretic analysis revealed the presence of an acidic 93-kDa protein (p93) in
Il team dei nostri ricercatori vanta grande esperienza in tutte le aree della ricerca quali Life Science, scienza dei materiali, sintesi chimica, cromatografia, discipline analitiche, ecc..
Contatta l'Assistenza Tecnica.