T7409
Tripsina
lyophilized powder, Type II-S, 1,000-2,000 units/mg dry solid
Autenticatiper visualizzare i prezzi riservati alla tua organizzazione & contrattuali
About This Item
Prodotti consigliati
Tipo
Type II-S
Livello qualitativo
Stato
lyophilized powder
Attività specifica
1,000-2,000 units/mg dry solid
PM
23.8 kDa
Temperatura di conservazione
−20°C
Cerchi prodotti simili? Visita Guida al confronto tra prodotti
Categorie correlate
Applicazioni
Per la digestione dei peptidi con tripsina, utilizzare un rapporto di circa 1:100-1:20 tra tripsina e peptide. L′uso tipico di questo prodotto è nella rimozione delle cellule aderenti dalla superficie di una coltura. La concentrazione di tripsina necessaria ad allontanare le cellule dal loro substrato dipende in primo luogo dal tipo cellulare e dall′età della coltura. Le tripsine sono state usate anche per risospendere le cellule durante la coltura, nella ricerca proteomica per la digestione delle proteine e in diverse digestioni tramite gel†. Ulteriori applicazioni includono la valutazione della cristallizzazione per mezzo di tecniche basate sulle membrane e in uno studio per accertare che la presenza di trappole cinetiche può limitare i tassi di ripiegamento e le rese delle proteine.
Azioni biochim/fisiol
La tripsina scinde i peptidi dall′estremità C-terminale dei residui della lisina e dell′arginina. Se su una o l′altra estremità del sito di scissione vi è un residuo acido, la velocità dell′idrolisi della reazione si riduce, mentre la presenza di un residuo di prolina sull′estremità carbossilica del sito di scissione interrompe l′idrolisi. Il pH ottimale per l′attività della tripsina è tra 7 e 9. La tripsina è anche in grado di scindere i legami esteri e ammidici dei derivati sintetici degli aminoacidi. Alle soluzioni di tripsina si aggiunge EDTA come agente chelante che neutralizza gli ioni calcio e magnesio che coprono i legami peptidici su cui agisce la tripsina. La rimozione di questi ioni aumenta l′attività enzimatica.
Gli inibitori delle serin proteasi, inclusi tra gli altri DFP, TLCK, APMSF, AEBSEF e aprotina inibiranno la tripsina
Gli inibitori delle serin proteasi, inclusi tra gli altri DFP, TLCK, APMSF, AEBSEF e aprotina inibiranno la tripsina
Componenti
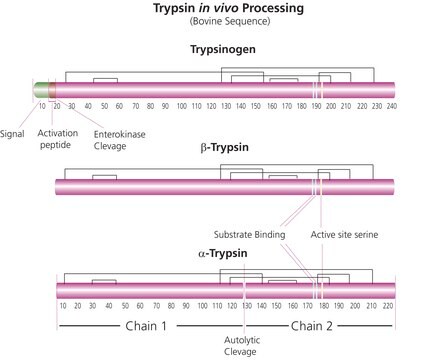
Trypsin consists of a single chain polypeptide of 223 amino acid residues, produced by the removal of the N-terminal hexapeptide from trypsinogen which is cleaved at the Lys - lle peptide bond. The sequence of amino acids is cross-linked by 6 disulfide bridges. This is the native form of trypsin, beta-trypsin. BETA-trypsin can be autolyzed, cleaving at the Lys - Ser residue, to produce alpha-trypsin. Trypsin is a member of the serine protease family.
Avvertenza
Solutions in 1 mM HCl are stable for 1 year in aliquots and stored at -20°C. The presence of Ca2+ will also diminish the self-autolysis of trypsin and maintain its stability in solution. Trypsin will also retain most of its activity in 2.0 M urea, 2.0 M guanidine HCl, or 0.1% (w/v) SDS.
Definizione di unità
Una unità BAEE produrrà un ΔA253 di 0,001 per minuto a pH 7,6 a 25 °C, usando BAEE come substrato. Una unità BTEE = 320 unità ATEE. Volume della reazione = 3,2 mL (1 cm via luminosa).
Nota sulla preparazione
This product is a lyophilized powder soluble in Hank′s Balanced Salt Solution at 25 mg/mL.
Inibitore
N° Catalogo
Descrizione
Determinazione del prezzo
Substrato
N° Catalogo
Descrizione
Determinazione del prezzo
Avvertenze
Danger
Indicazioni di pericolo
Consigli di prudenza
Classi di pericolo
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
Organi bersaglio
Respiratory system
Codice della classe di stoccaggio
11 - Combustible Solids
Classe di pericolosità dell'acqua (WGK)
WGK 1
Dispositivi di protezione individuale
dust mask type N95 (US), Eyeshields, Faceshields, Gloves
Scegli una delle versioni più recenti:
Possiedi già questo prodotto?
I documenti relativi ai prodotti acquistati recentemente sono disponibili nell’Archivio dei documenti.
I clienti hanno visto anche
Tanja Laske et al.
PLoS computational biology, 15(4), e1006944-e1006944 (2019-04-12)
The best measure to limit spread of contagious diseases caused by influenza A viruses (IAVs) is annual vaccination. The growing global demand for low-cost vaccines requires the establishment of high-yield production processes. One possible option to address this challenge is
Daniel Rüdiger et al.
PLoS computational biology, 15(2), e1006819-e1006819 (2019-02-20)
Influenza A viruses (IAV) are commonly used to infect animal cell cultures for research purposes and vaccine production. Their replication is influenced strongly by the multiplicity of infection (MOI), which ranges over several orders of magnitude depending on the respective
Fan Zhao et al.
Molecular nutrition & food research, 63(23), e1900589-e1900589 (2019-10-08)
The gut microbiota plays an essential role in linking diet to host health. The specific role of different dietary proteins on the gut microbiota and health is less understood. Here, the impact of proteins derived from chicken and soy on
Xiaoyu Zou et al.
Frontiers in nutrition, 7, 151-151 (2020-10-20)
In this work, we investigated changes in protein structures in vacuum-packed pork during chill storage and its impact on the in vitro protein digestion. Longissimus dorsi muscles were vacuum packed and stored at 4°C for 3 days. Samples were subjected
Shulin Zhang et al.
Autophagy, 13(8), 1318-1330 (2017-06-09)
Magnaporthe oryzae, the ascomycete fungus that causes rice blast disease, initiates conidiation in response to light when grown on Prune-Agar medium containing both carbon and nitrogen sources. Macroautophagy/autophagy was shown to be essential for M. oryzae conidiation and induced specifically
Il team dei nostri ricercatori vanta grande esperienza in tutte le aree della ricerca quali Life Science, scienza dei materiali, sintesi chimica, cromatografia, discipline analitiche, ecc..
Contatta l'Assistenza Tecnica.