Kanoniczna sygnalizacja Wnt / β-kateniny
Tło
.Składniki sygnalizacji Wnt
a) Białko Wnt
b) Receptory białek Wnt
c) Modulatory sygnalizacji Wnt
.Mechanizm sygnalizacji Wnt /beta-katenina
a) Sygnalizacja Wnt - wyłączona
a) Sygnalizacja Wnt - wyłączona
b) Sygnalizacja Wnt - wyłączona
b) Sygnalizacja Wnt - Włączona
c) Geny docelowe Wnt
.Funkcje sygnalizacji Wnt
Konkluzja
Background
Sygnał Wnt ma kluczowe znaczenie dla niezliczonych funkcji biologicznych, w tym determinacji losu komórek, migracji komórek, polaryzacji komórek, organogenezy i patterningu neuronalnego podczas embriogenezy1. Białka Wnt w niszy komórek macierzystych kontrolują zachowanie różnych typów komórek macierzystych, utrzymując je w stanie samoodnowy. Zewnątrzkomórkowe białka Wnt stymulują kilka kaskad transdukcji sygnału, które są klasyfikowane jako kanoniczne lub szlak Wnt/β-kateniny i niekanoniczne lub szlak niezależny od β-kateniny2. Sygnalizacja Wnt/β-katenina jest dobrze zbadana, a obecny przegląd koncentruje się na składnikach i mechanizmie sygnalizacji zależnej od β-kateniny.
Składniki sygnalizacji Wnt
Wnt ulega wszechobecnej ekspresji u wszystkich zwierząt metazoicznych. Istnieje 19 genów ssaków, które kodują bogate w cysteinę białka Wnt, należące do 12 konserwatywnych podrodzin Wnt. Białka Wnt są kuliste, około 40 KDa; domena amino-końcowa składa się głównie z α-heliksów z pięcioma mostkami dwusiarczkowymi, podczas gdy domena karboksy-końcowa jest zdominowana przez dwa β-sheety z sześcioma wiązaniami dwusiarczkowymi. Białka Wnt ulegają modyfikacjom potranslacyjnym, zanim zostaną uwolnione do zewnątrzkomórkowego środowiska cytoplazmatycznego. Wnt jest glikozylowane i palmitoilowane przez białko retikulum endoplazmatycznego zwane Porcupine3 (Porc) i transportowane do błony plazmatycznej przez białka Wntless (Wls). Utrata Porc4 lub Wls5 zapobiega wydzielaniu białek Wnt, prowadząc do wad wrodzonych. Wiadomo, że białka Wnt działają w sposób zależny od kontaktu, jak również w odległych tkankach. Szlak Wnt/β-katenina jest wynikiem znaczącej sygnalizacji bliskiego zasięgu wraz z beta-kateniną6.
Lipoproteina Wnt wiąże się z kompleksem receptorowym, który składa się z białka Frizzled (Fz) i lipopolisacharydopodobnego białka receptorowego 5/6 (LRP5/6). Białko Frizzled ma siedem domen transbłonowych i dużą zewnątrzkomórkową N-końcową domenę bogatą w cysteinę, która stanowi platformę dla wiązania Wnt. Interakcja między białkiem Wnt i Fz nie jest specyficzna; pojedyncze białko Wnt może wiązać się z wieloma białkami Fz. W przeciwieństwie do białka Fz, LRP6 ma specyficzne miejsca wiązania dla różnych klas białek Wnt7. Wiązanie ligandu (Wnt) powoduje zmiany konformacyjne w receptorach (LRP6), aktywując kinazy takie jak GSK3 i CK1γ8. Zarówno GSK39 jak i CK1γ10 ostatecznie fosforylują kilka składników sygnałowych szlaku Wnt, w tym β-kateninę, aksynę, APC i LRP. Niewiele wiadomo na temat roli Fz w szlaku Wnt. Po otrzymaniu sygnału domena cytoplazmatyczna receptora Fz oddziałuje z białkami Dishevelled (Dsh) i ułatwia interakcję między ogonem LRP a aksyną. Zarówno białka Axin, jak i Dsh wiążą się ze sobą poprzez domenę DIX i pośredniczą w tworzeniu dimerów LRP-Fz.
c) Modulatory sygnalizacji Wnt
Sygnał Wnt/β-katenina jest modulowany przez zewnątrzkomórkowe ligandy wymienione w poniższej tabeli.
Mechanizm sygnalizacji Wnt/beta-kateniny
Stabilność cytoplazmatycznej β-kateniny jest krytyczna dla wydajności sygnalizacji Wnt. β-katenina (781 aminokwasów) składa się z centralnego regionu 141-664 aminokwasów składającego się z powtórzeń armadillo, otoczonych odrębnymi domenami N- i C-końcowymi (NTD i CTD). Chociaż NTD i CTD są strukturalnie elastyczne, region centralny jest sztywny i służy jako platforma interakcji dla białek wiążących w cytozolu i jądrze. Stabilność β-kateniny zależy od tego, co jest obecnie określane jako "cytoplazmatyczny kompleks destrukcyjny" składający się z aksyny, dwóch białek supresorowych nowotworów APC i WTX oraz dwóch konstytutywnie aktywnych kinaz, CK1α/δ i GSK3α/β.
a) Sygnalizacja Wnt - "Off"
Pod nieobecność Wnt, los β-kateniny jest określany przez kinazy, CK1 i GSK3.
- Fosforylacja: β-katenina jest fosforylowana przez CK1 na Ser45, Ser33 i Ser37 oraz przez GSK3 na Thr41
- Ubiquitination: Fosforylowana β-katenina jest ukierunkowana na ubikwitynację za pośrednictwem β-Trcp i późniejszą degradację przez proteasom16.
- Transkrypcyjna represja: W przypadku braku β-kateniny, czynniki transkrypcyjne takie jak TCF wiążą się z Groucho, represorem transkrypcji, który zapobiega transkrypcji genów docelowych.
b) Sygnalizacja Wnt - "On"
W obecności ligandów Wnt inicjowana jest kaskada sygnalizacyjna.
- Dysocjacja kompleksu niszczącego: Wiązanie ligandów Wnt z receptorami Frizzled i LRP5/6 uruchamia serię zdarzeń, które ostatecznie rozbijają kompleks APC/Axin/GSK3β (destrukcji) i stabilizują β-kateninę.
- Translokacja β-kateniny: β-katenina gromadzi się w cytoplazmie i może swobodnie przemieszczać się do jądra.
- Regulacja transkrypcyjna: W jądrze β-katenina działa jako koaktywator transkrypcyjny czynników transkrypcyjnych z rodziny TCF/LEF. Inni partnerzy wiążący Legless i Pygopus utrzymują jądrową retencję i zdolność transaktywacji β-kateniny17-19.
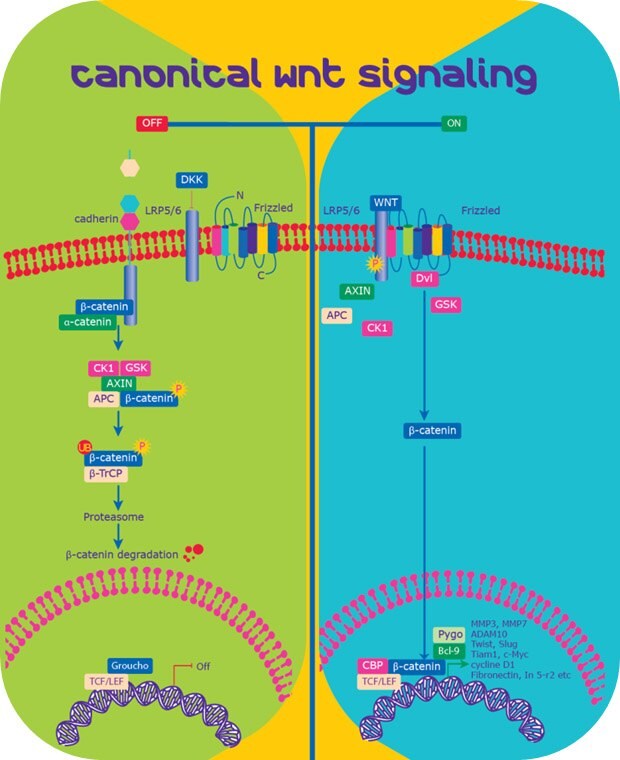
Rysunek 1.Szlak sygnałowy Wnt/β-katenina
c) Geny docelowe Wnt
Geny regulowane przez sygnalizację Wnt obejmują geny czynników transkrypcyjnych, składników ECM, białek adhezji komórkowej, enzymów i hormonów (Tabela 2).
Funkcje sygnalizacji Wnt
Wśród szeroko rozpowszechnionych efektów sygnalizacji Wnt na komórki docelowe, rola w regulacji plastyczności komórek macierzystych przyciągnęła szczególne zainteresowanie.
Zarodkowe komórki macierzyste: Kanoniczny szlak Wnt utrzymuje samoodnowę zarodkowych komórek macierzystych.Agonista Wnt, taki jak R-Spondin, pośredniczy w pluripotencji w mysich embrionalnych komórkach macierzystych, co ma znaczenie kliniczne w leczeniu chorób zwyrodnieniowych32,33.
Mezenchymalne komórki macierzyste: Aktywacja kanonicznego szlaku Wnt promuje osteogeniczne różnicowanie mezenchymalnych komórek macierzystych. Intensywność sygnału Wnt/β-kateniny determinuje los mezenchymalnych komórek macierzystych, w których proliferacja i samoodnowa były indukowane przy niskich poziomach Wnt/β-kateniny, podczas gdy różnicowanie osteogenne jest wyzwalane przy wysokich poziomach sygnalizacji Wnt34.
Komórki macierzyste jelita: Wnt/β-katenina reguluje różnicowanie komórek macierzystych w jelicie. Zahamowanie sygnalizacji Wnt za pośrednictwem ekspresji Dkk-1 indukuje całkowitą utratę krypt, źródła samoodnawiających się tkanek w jelicie. Natomiast aktywacja sygnalizacji Wnt stymuluje proliferację progenitorów krypt.
Hematopoietic Stem Cells: Aktywacja Wnt/β-kateniny zwiększa progenitory hematopoetyczne. Zablokowanie Wnt3a zmniejszyło liczbę komórek progenitorowych35 a nadekspresja aktywowanej β-kateniny spowodowała ekspansję hematopoetycznych komórek macierzystych36.
Komórki macierzyste mieszków włosowych: Sygnalizacja Wnt jest ważna dla ustanowienia mieszka włosowego i aktywuje komórki macierzyste. Warunkowa utrata β-kateniny w nabłonku skóry prowadzi do zubożenia komórek macierzystych mieszków włosowych37.
Regulacja mikrotubul: Wnt reguluje stabilność i organizację mikrotubul, które wpływają na wyrównanie wrzecion mitotycznych i segregację chromosomów podczas podziału komórki; te z kolei wpływają na migrację i polaryzację komórek. Wnt indukuje również zmiany w morfologii i zachowaniu aksonów poprzez wiązanie mikrotubul, które zmniejszają wydłużenie aksonu i zwiększają jego rozgałęzienie38.
Metabolizm nowotworów: Kanoniczny szlak Wnt i jego efektory regulują proliferację komórek, ich śmierć, starzenie się i przerzuty39. Składniki szlaku Wnt są często zmutowane (Tabela 2), co wskazuje na jego rolę w progresji nowotworów.
Wnioski
Sygnał Wnt jest konserwowany przez całą ewolucję i istnieje silna korelacja między rozregulowanymi sygnałami Wnt a wieloma stanami chorobowymi. Białka Wnt są aktywne w komórkach macierzystych tkanek nerwowych, sutkowych i embrionalnych. Doniesiono, że podczas gdy zdefiniowane czynniki, takie jak LIF, Basic FGF, Hedgehog, BMP-4 utrzymują embrionalne komórki macierzyste w stanie niezróżnicowanym, białka Wnt odgrywają rolę w kontroli komórek ES. Wzajemne oddziaływanie białek Wnt i innych czynników, w tym małych cząsteczek, takich jak kwas retinowy, w celu utrzymania, samoodnowy i różnicowania komórek macierzystych jest ważnym obszarem badań, który ma ogromne implikacje w sposobie, w jaki komórki macierzyste kształtują obecne opcje terapii chorób.
Zapoznaj się z wysokiej jakości rekombinowanymi białkami Wnt do użytku badawczego
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?