Oczyszczanie plazmidowego DNA bez użycia endotoksyny
Zestawy do oczyszczania plazmidowego DNA, które zmniejszają poziom endotoksyny, zwykle mają długie i żmudne protokoły. Zestaw GenElute™ HP Endotoxin-Free Plasmid Maxiprep Kit umożliwia szybką izolację plazmidowego DNA wolnego od endotoksyny. Zestaw jest zgodny z uproszczoną procedurą, którą można ukończyć w zaledwie 35 minut. Łączy w sobie wygodę formatu wiązania, płukania i elucji ze zoptymalizowanym roztworem wiążącym, który zapobiega przenoszeniu endotoksyn do produktu końcowego. Pozwala to badaczom konsekwentnie osiągać poziomy endotoksyny mniejsze niż 0,1 jednostki endotoksyny na µg plazmidowego DNA bez konieczności poświęcania wysokich odzysków plazmidu.
Czym są endotoksyny?
Endotoksyny, znane również jako lipopolisacharydy (LPS), są głównym składnikiem tworzącym zewnętrzną błonę bakterii Gram-ujemnych. Około trzy czwarte powierzchni bakterii składa się z tych cząsteczek.1 Zewnętrzna błona stanowi barierę, która chroni komórkę przed dużymi cząsteczkami i związkami hydrofobowymi, ale jest przepuszczalna dla małych cząsteczek hydrofilowych, które są niezbędne do przetrwania komórki.2 Endotoksyny mogą również odgrywać ważną rolę w interakcjach komórek gospodarza, takich jak kolonizacja i odporność na fagocytozę.2
Podstawowa struktura endotoksyny jest podobna wśród bakterii Gram-ujemnych, ale skład chemiczny może się znacznie różnić. Struktura składa się z trzech odrębnych regionów: lipidu A, oligosacharydu rdzenia i antygenu O (Rysunek 1). Lipid A jest hydrofobowym, zakotwiczonym w błonie regionem endotoksyny i jest wysoce konserwowany wśród bakterii Gram-ujemnych.1 Składa się z dimeru N-acetyloglukozaminy (NAG) z przyłączonymi 6 do 7 kwasami tłuszczowymi.2 Podstawowy oligosacharyd jest przyłączony do dimeru NAG i składa się z krótkiego łańcucha cukrów. Region ten jest konserwowany między członkami określonego rodzaju bakterii, ale będzie się różnić między rodzajami.2 Trzecim składnikiem endotoksyny jest antygen O, który jest hydrofilową częścią endotoksyny, która rozciąga się do środowiska komórek. O-antygen jest przyłączony do oligosacharydu rdzenia i składa się z 15 do 20 powtarzających się podjednostek od trzech do pięciu cukrów.3 Skład tych cukrów jest zależny od szczepu i może być stosowany do rozróżniania różnych szczepów bakterii.4
Endotoksyny są powszechnym zanieczyszczeniem w preparatach kwasów nukleinowych, szczególnie podczas oczyszczania plazmidowego DNA. Podczas lizy komórek, wysokie stężenia endotoksyn są uwalniane do lizatu. Podobnie jak DNA, endotoksyny są naładowane ujemnie i są współczyszczone z plazmidowym DNA zarówno w systemach opartych na krzemionce, jak i anionowymiennych. Monomery endotoksyny zwykle wahają się między 10 a 20 kDa, ale mogą tworzyć duże agregaty większe niż 1000 kDa5 co skutkuje współczyszczeniem w kolumnach wykluczania wielkości i gradientach gęstości chlorku cezu. Dlatego zarówno standardowe, jak i tradycyjne systemy oczyszczania plazmidów mogą powodować wysoki poziom endotoksyny zanieczyszczającej oczyszczone plazmidowe DNA.
Chociaż nie każda technika biologii molekularnej wymaga użycia plazmidowego DNA wolnego od endotoksyny, transfekcja wrażliwych linii komórkowych ssaków jest głównym zastosowaniem, w którym DNA wolne od endotoksyny jest niezbędne. Transfekcję można zdefiniować jako wprowadzenie obcego DNA lub RNA do komórki eukariotycznej. W praktyce geny są transfekowane do komórek, aby można było badać ich regulację i ekspresję. Dane wykazały, że endotoksyny zmniejszają żywotność komórek i skuteczność transfekcji wśród różnych eukariotycznych linii komórkowych, takich jak komórki COS-7 i Jurkat.6 Ponadto niektóre linie komórkowe wydają się być bardziej wrażliwe na endotoksyny niż inne, takie jak komórki HuH-7.6 Wiadomo, że endotoksyny mogą mieć złożony wpływ na układy ssaków, takie jak niespecyficzna aktywacja układu odpornościowego, stymulacja nadprodukcji cytokin i indukcja zespołu wstrząsu toksycznego.7 Zasadniczo, endotoksyny wprowadzają zmienną, która może wpływać na wynik i powtarzalność danego eksperymentu transfekcji.
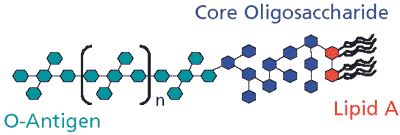
Rysunek 1.Schemat endotoksyny bakteryjnej (lipopolisacharydu).
Metoda oczyszczania plazmidu
Przygotowanie hodowli
Rekombinowane E. coli szczepy DH5α pCMV-SPORT-β-gal (Invitrogen, Carlsbad, CA) i HB101 pBICEP-CMV-1-LacZ (nr produktu. E0779) zaszczepiono do podłoża LB zawierającego 100 µg/ml ampicyliny (nr produktu A9518). Hodowle bakteryjne hodowano, wytrząsając przy 275 obrotach na minutę przez 17 godzin w temperaturze 37 °C.
Przygotowanie plazmidów
Każdą próbkę przygotowano przez zebranie 150 ml kultury bakteryjnej przez odwirowanie przy 5000 x g przez 10 minut. Pelety zostały dokładnie zawieszone w 12 ml Resuspension Solution, a następnie poddane zmodyfikowanej lizie alkaliczno-SDS poprzez dodanie 12 ml Lysis Solution. Lizaty zneutralizowano dodając 12 ml Roztworu Neutralizującego, co spowodowało utworzenie białego kłaczkowatego osadu zawierającego zdenaturowane białka, lipidy, SDS, chromosomalne DNA i inne pozostałości komórkowe.
Lizaty przeniesiono na poszczególne filtry i inkubowano w temperaturze pokojowej przez 5 minut. Lizaty przeciągnięto przez filtry za pomocą próżni, uzyskując klarowny lizat. Sklarowane lizaty przygotowano do załadowania na kolumny wiążące poprzez dodanie 9 ml roztworu wiążącego. Kolumny wiążące przygotowano poprzez podłączenie ich do standardowego laboratoryjnego kolektora próżniowego, a następnie dodanie 12 ml roztworu do przygotowania kolumn, który został zassany próżniowo. Mieszaniny lizatów zostały załadowane na kolumny wiążące i przepuszczone przez nie próżniowo. Zanieczyszczenia zostały usunięte z kolumn poprzez przemycie 12 ml Roztworu Płuczącego 1, a następnie 12 ml Roztworu Płuczącego 2. Kolumny pozostawiono do wyschnięcia na 10 minut, wciąż pod próżnią, a następnie przeniesiono do indywidualnych probówek zbiorczych. Na koniec plazmidowe DNA eluowano przez dodanie 3 ml wody wolnej od endotoksyn i odwirowanie z prędkością 3000 x g przez 5 minut. Odzyskane eluaty były następnie gotowe do analizy i wykorzystania w dalszych aplikacjach.
Analiza plazmidów
Stężenia plazmidów określano poprzez odczyty absorbancji przy 260 nm. Całkowita wydajność (mg) została obliczona przez pomnożenie stężenia przez objętość odzyskanego eluatu. Czystość próbek określono obliczając stosunek absorbancji przy 260 nm/280 nm. Próbki naniesiono na 1% żel agarozowy TBE przy napięciu 100 V i poddano oględzinom w celu potwierdzenia ich wydajności i czystości.
Testowanie endotoksyn
Poziomy endotoksyn określono przy użyciu zestawu QCL-1000 Quantitative Chromogenic LAL Kit (BioWhittaker, Walkersville, MD) zgodnie z metodą probówkową.
Transfekcja przejściowa i pomiar aktywności genów reporterowych
Linia komórkowa ludzkiego wątrobiaka (HuH-7; dostarczona przez dr Clifforda J. Steera, University of Minnesota Medical School) była hodowana w pożywce Dulbecco's Modified Eagle's Medium (D-MEM). Pożywkę uzupełniono 10% płodową surowicą bydlęcą (FBS) i 4 mM L-glutaminą. Do celów transfekcji, komórki HuH-7 wysiano w ilości około 1,0-1,5 x 105 komórek na studzienkę w 2 ml pożywki wzrostowej na 6-dołkowe płytki do hodowli tkankowej (Corning Inc., Corning, NY). Płytki utrzymywano w nawilżanym CO2 inkubatorze w temperaturze 37 °C, aż komórki osiągnęły 60-70% konfluencji, co zwykle trwało 24-30 godzin.
Komórki poddano transfekcji za pomocą odczynnika do transfekcji ESCORT II™ (Product No. L6037), zgodnie z protokołem informacyjnym produktu, chyba że określono inaczej. Podsumowując, dla jednej studzienki 6-dołkowej płytki hodowlanej, 15 µl uwodnionego odczynnika ESCORT II rozcieńczono 60 µl pozbawionego surowicy D-MEM w sterylnej probówce mikrofugowej. Następnie 3 µg oczyszczonego plazmidowego DNA rozcieńczono 75 µl rozcieńczalnika DNA (nr produktu D6813). Ta mieszanina była inkubowana w temperaturze pokojowej przez 1 do 5 minut.
Rozcieńczona próbka DNA została następnie dodana do mieszaniny ESCORT II/bez surowicy D-MEM i inkubowana w temperaturze pokojowej przez 5 do 10 minut. Podczas tej inkubacji komórki HuH-7 zostały delikatnie przepłukane dwukrotnie 2 ml D-MEM bez surowicy przed dodaniem 850 µL D-MEM bez surowicy do każdego dołka. Kompleks ESCORT II/DNA został następnie dodany bezpośrednio do komórek HuH-7. Komórki inkubowano w inkubatorze do hodowli tkankowej CO2 w temperaturze 37 °C przez 4 do 5 godzin, po czym dodano 1 ml D-MEM uzupełnionego 20% FBS i 4 mM L-glutaminą. Jako kontrolę negatywną, komórki HuH-7 poddano działaniu tej samej mieszaniny transfekcyjnej bez plazmidowego DNA.
Wydajność transfekcji określono analizując ekstrakty komórek HuH-7 pod kątem aktywności genów 72 godziny po rozpoczęciu transfekcji. Aktywność ta została zmierzona przy użyciu zestawu do wykrywania aktywności genu reporterowego β-galaktozydazy (Product No. GAL-A) zgodnie z protokołem informacji o produkcie zestawu. Wydajność transfekcji podano jako jednostki β-galaktozydazy na płytkę, co stanowi średnią z sześciu niezależnych powtórzeń transfekcji dla każdej próbki.
Wyniki oczyszczania plazmidów i dyskusja
Zestaw GenElute™ HP Endotoxin-Free Maxiprep Kit został oceniony poprzez oczyszczenie dwóch różnych plazmidów z dwóch różnych E. coli szczepów. Po oczyszczeniu plazmidy analizowano pod kątem odzysku i czystości. Obliczona wydajność dla plazmidów pCMV-SPORT-β-gal i pBICEP-CMV-1-LacZ była bardzo wysoka; 1,4 mg plazmidowego DNA odzyskano z 150-ml hodowli LB dla obu. Stwierdzono również, że każda próbka ma wysoką czystość, na co wskazuje stosunek absorbancji przy 260 nm/280 nm wynoszący 1,9. Stosunki między 1,8 a 2,0 zazwyczaj wskazują na preparaty plazmidowe wysokiej jakości. Czystość została również potwierdzona przez elektroforezę w żelu agarozowym, która nie wykazała żadnych dowodów na zanieczyszczenie genomowym DNA lub RNA (dane nie pokazane).
Dla celów porównawczych trzy inne dostępne na rynku zestawy zostały użyte do przygotowania plazmidów z tych samych kultur bakteryjnych, które zostały użyte do przygotowania próbek opisanych powyżej. Pierwszy zestaw wykorzystuje system oparty na krzemionce niezawierający endotoksyn, drugi to zestaw wolny od endotoksyn, który wykorzystuje technologię wymiany anionów, a trzeci to zestaw oparty na krzemionce redukujący endotoksyny, który zawiera cząstki magnetyczne w procesie oczyszczania. Wszystkie próbki zostały przygotowane zgodnie z protokołami producenta. Dodatkowo, plazmid pCMV-SPORT-β-gal został przygotowany z oddzielnej hodowli poprzez oczyszczanie na dwóch oddzielnych gradientach chlorku cezu (2X CsCl banding). Chociaż nie jest to metoda wolna od endotoksyn, od dawna uważana jest za standard w przygotowywaniu wysoce oczyszczonego plazmidowego DNA. Oczyszczony lizat dla próbki CsCl został przygotowany identycznie jak próbki oczyszczone przy użyciu zestawu GenElute™ HP Endotoxin-Free Maxiprep Kit. Plazmidowe DNA zostało następnie wytrącone przez dodanie octanu sodu i izopropanolu, a następnie odwirowane. Osad plazmidowego DNA wysuszono, a następnie ponownie zawieszono w buforze TE o pH 8,0. Protokół Sambrooka i Russella8 został zastosowany do przygotowania gradientów chlorku cezu i dalszego oczyszczania plazmidowego DNA.
Wydajność plazmidu dla wszystkich preparatów obliczono na podstawie odczytów absorbancji wykonanych przy 260 nm. Wyniki podano w miligramach (mg) i porównano w tabelach 1 i 2. Wydajność plazmidów uzyskanych z zestawu GenElute™ HP Endotoxin-Free Plasmid Maxiprep Kit była podobna lub lepsza niż u konkurencji. Następnie określono poziomy endotoksyny przy użyciu zestawu Chromogenic LAL firmy BioWhittaker. Wyniki zostały przedstawione jako jednostki endotoksyny na mikrogram plazmidu i porównane w Tabelach 1 i 2.
Zestaw GenElute™ HP Endotoxin-Free Plasmid Maxiprep Kit wykazał znaczną redukcję endotoksyn w porównaniu do podobnego zestawu opartego na krzemionce. Poziomy endotoksyn były również jednymi z najniższych w porównaniu z innymi dostępnymi zestawami wolnymi od endotoksyn, a także próbką 2X CsCl. Ponadto w Tabelach 1 i 2 porównano ilość czasu na przygotowanie; ujawniło to najbardziej znaczącą różnicę między zestawami niezawierającymi endotoksyn. Zestaw GenElute™ HP Endotoxin-Free Plasmid Maxiprep Kit potrzebował zaledwie 35 minut, podczas gdy dwa inne konkurencyjne zestawy wolne od endotoksyny trwały ponad cztery razy dłużej. Tylko inny system oparty na krzemionce był porównywalny pod względem czasu przygotowania, ale oczyszczona próbka miała wyższy poziom endotoksyny.
W celu dalszej oceny plazmidu oczyszczonego przy użyciu zestawu GenElute™ HP Endotoxin-Free Plasmid Maxiprep Kit, próbka z każdego preparatu została transfekowana do komórek HuH-7, ludzkiej linii komórkowej wątrobiaka. Komórki HuH-7 zostały wybrane do tego eksperymentu, ponieważ stwierdzono, że są one bardziej wrażliwe na endotoksyny podczas transfekcji niż inne powszechnie stosowane linie komórkowe.6 Transfekcje przeprowadzono również z próbkami przygotowanymi z innych dostępnych na rynku zestawów, a także z próbką 2X CsCl. Plazmidy pCMV-SPORT-β-gal i pBICEP-CMV-1- LacZ zawierają gen reporterowy β-laktamazy i mogą być wykrywane za pomocą zestawu do wykrywania β-galaktozydazy po transfekcji.
Dane dotyczące wydajności transfekcji dla próbek pCMV-SPORT-β-gal przedstawiono na Rysunku 2. Wyniki pokazują, że próbka oczyszczona przy użyciu zestawu GenElute™ HP Endotoxin-Free Plasmid Maxiprep Kit miała najwyższą wydajność transfekcji w porównaniu z innymi dostępnymi na rynku zestawami. Próbka HP Endotoxin-Free Maxiprep przewyższała również próbkę 2X CsCl, która była kiedyś uważana za standard czystości. Dane dotyczące skuteczności transfekcji dla próbek pBICEP-CMV-1-LacZ przedstawiono na Rysunku 3. Wzorce wydajności były prawie identyczne z tymi obserwowanymi dla próbek pCMV-SPORT-β-gal. Skuteczność transfekcji dla zestawu GenElute HP Endotoxin-Free Plasmid Maxiprep Kit była najwyższa, przewyższając nawet zestaw do wymiany anionów, który miał nieco niższy poziom endotoksyn. Wynik ten sugeruje możliwość występowania innych zanieczyszczeń poza endotoksynami, które mogą wpływać na skuteczność transfekcji. Te eksperymenty transfekcji pokazują, że plazmid oczyszczony przy użyciu zestawu GenElute ™ HP Endotoxin-Free Plasmid Maxiprep Kit jest wysokiej jakości i przewyższa konkurencję, a także tradycyjne metody, takie jak pasmowanie 2X CsCl.
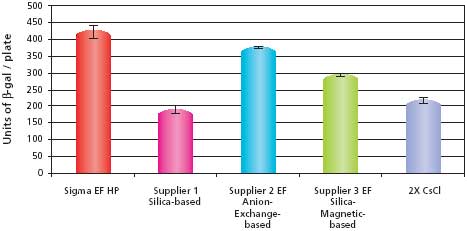
Rysunek 2.Porównanie wydajności transfekcji do komórek HuH-7 przy użyciu różnych systemów oczyszczania z pCMV-SPORT-β-gal. Dane pokazują średnią i odchylenia standardowe sześciu powtórzeń z każdej przygotowanej próbki. Nietransfekowane komórki HuH-7 nie wykazywały aktywności β-galaktozydazy (dane nie pokazane). Szczegóły opisano w sekcji Materiały i metody.
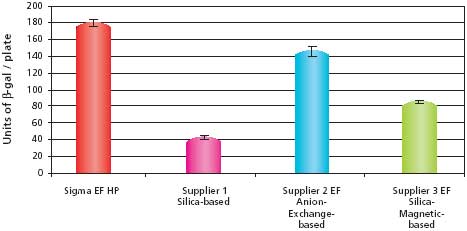
Rysunek 3.Porównanie skuteczności transfekcji komórek HuH-7 przy użyciu różnych systemów oczyszczania z pBICEP-CMV-1-LacZ. Dane pokazują średnią i odchylenia standardowe sześciu powtórzeń z każdej przygotowanej próbki. Nietransfekowane komórki HuH-7 nie wykazywały aktywności β-galaktozydazy (dane nie pokazane). Szczegóły opisano w sekcji Materiały i metody.
Zestaw GenElute™ HP Endotoxin-Free Plasmid Maxiprep Kit to unikalny system, który zapewnia wysoki odzysk plazmidów z poziomami endotoksyny, które są stale poniżej standardu branżowego wynoszącego 0,1 EU/µg. Innowacyjna technologia zestawu w połączeniu z prostą procedurą umożliwia użytkownikowi ukończenie procesu w 35 minut, co czyni go najszybszym dostępnym zestawem wolnym od endotoksyn. Zestaw GenElute™ HP Endotoxin-Free Maxiprep Kit przewyższa zarówno obecne, jak i tradycyjne metody oczyszczania, dostarczając wysokiej jakości plazmidowe DNA niezbędne do wysokowydajnej transfekcji wrażliwych eukariotycznych linii komórkowych.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?