Protokoły ELISA
Protokoły te są przeznaczone wyłącznie do ogólnego użytku jako wytyczne. Prosimy o zapoznanie się ze szczegółowym protokołem konkretnego zestawu ELISA na stronie szczegółów produktu. Wyszukaj wszystkie testy ELISA na naszej stronie centrum ELISA.
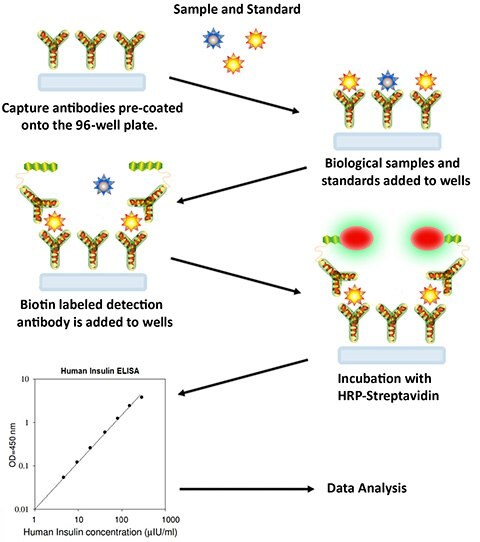
Procedura testu Sandwich
- Przed użyciem doprowadzić wszystkie odczynniki i próbki do temperatury pokojowej (18 - 25 °C). Zaleca się, aby wszystkie standardy i próbki były wykonywane co najmniej w dwóch egzemplarzach.
- Dodaj 100 µL każdego standardu i próbki do odpowiednich dołków. Przykryć studzienki i inkubować przez 2,5 godziny w temperaturze pokojowej lub przez noc w temperaturze 4°C z delikatnym wytrząsaniem.
- Odrzucić roztwór i przemyć 4 razy roztworem 1X Wash Solution. Przepłukać, wypełniając każdy dołek buforem do płukania (300 µL) za pomocą pipety wielokanałowej lub automatycznej myjki. Całkowite usunięcie cieczy na każdym etapie jest niezbędne do uzyskania dobrej wydajności. Po ostatnim płukaniu usuń wszelkie pozostałości buforu płuczącego przez odsysanie lub dekantację. Odwrócić płytkę i osuszyć ją czystym ręcznikiem papierowym.
- Dodać 100 µl 1x przygotowanego przeciwciała detekcyjnego do każdego dołka. Przykryć dołki i inkubować przez 1 godzinę w temperaturze pokojowej, delikatnie wstrząsając.
- Odrzucić roztwór. Powtórz procedurę płukania jak w kroku 3.
- Dodaj 100 µL przygotowanego roztworu streptawidyny do każdego dołka. Przykryć studzienki i inkubować przez 45 minut w temperaturze pokojowej z delikatnym wstrząsaniem.
- Odrzucić roztwór. Powtórzyć płukanie jak w kroku 3.
- Dodać 100 µl jednoetapowego odczynnika substratu TMB (pozycja H) do każdego dołka. Przykryj studzienki i inkubuj przez 30 minut w temperaturze pokojowej w ciemności, delikatnie wstrząsając.
- Dodaj 50 µL roztworu zatrzymującego (pozycja I) do każdej studzienki. Natychmiast odczytać absorbancję przy długości fali 450 nm.
Procedura testu fosforylacji
- Przed użyciem doprowadzić wszystkie odczynniki do temperatury pokojowej (18 - 25 °C). Zaleca się, aby wszystkie próbki lub kontrola pozytywna były wykonywane co najmniej w dwóch egzemplarzach.
- Dodaj 100 µL każdej próbki lub kontroli pozytywnej do odpowiednich studzienek. Przykryj studzienkę uchwytem płytki i inkubuj przez 2,5 godziny w temperaturze pokojowej lub przez noc w temperaturze 4°C z wytrząsaniem.
- Odrzuć roztwór i przemyj 4 razy 1x Roztworem Płuczącym. Przepłukać, wypełniając każdą studzienkę buforem do płukania (300 µL) za pomocą pipety wielokanałowej lub automatycznej myjki. Całkowite usunięcie cieczy na każdym etapie jest niezbędne do uzyskania dobrej wydajności. Po ostatnim płukaniu usunąć wszelkie pozostałości buforu płuczącego przez odsysanie. Odwrócić płytkę i osuszyć ją czystym ręcznikiem papierowym.
- Dodać 100 µl przygotowanego 1X biotynylowanego przeciwciała antyfosfotyrozynowego do każdego dołka. Inkubować przez 1 godzinę w temperaturze pokojowej z wytrząsaniem.
- Odrzucić roztwór. Powtórzyć płukanie jak w kroku 3.
- Dodać 100 µl przygotowanego 1X roztworu HRP-Streptawidyna (patrz Przygotowanie odczynników, krok 6) do każdego dołka. Inkubować przez 45 minut w temperaturze pokojowej z wytrząsaniem.
- Odrzucić roztwór. Powtórzyć płukanie jak w kroku 3.
- Dodać 100 µl jednoetapowego odczynnika substratu TMB (pozycja H) do każdego dołka. Inkubować przez 30 minut w temperaturze pokojowej w ciemności z wytrząsaniem.
- Dodaj 50 µL roztworu zatrzymującego (pozycja I) do każdego dołka. Natychmiast odczytać przy długości fali 450 nm.

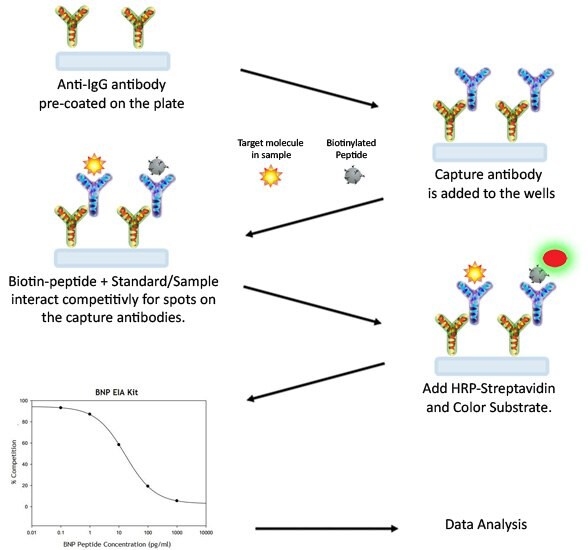
Procedura testu EIA
- Przechowywać odczynniki zestawu na lodzie podczas etapów przygotowywania odczynników. Zaleca się, aby wszystkie wzorce i próbki były wykonywane co najmniej w dwóch egzemplarzach.
- Dodaj 100 μL przeciwciała przeciw "celowi" do każdego dołka. Inkubować przez 1,5 godziny w temperaturze pokojowej z delikatnym wytrząsaniem (1-2 cykle/s). Można również inkubować przez noc w temperaturze 4°C.
- Odrzuć roztwór i przemyj dołki 4 razy 1x buforem do przemywania (200-300 μl każdy), Przemywanie można wykonać za pomocą pipety wielokanałowej lub automatycznej myjki do płytek. Całkowite usunięcie cieczy na każdym etapie jest niezbędne dla dobrej wydajności testu. Po ostatnim płukaniu należy usunąć wszelkie pozostałości buforu do płukania przez odessanie lub dekantację. Odwróć płytkę i osusz ją czystym ręcznikiem papierowym.
- Dodaj 100 μL każdego standardu, kontroli pozytywnej i próbki do odpowiednich dołków. Upewnij się, że dołączony jest ślepy dołek (tylko rozcieńczalnik testowy). Przykryj studzienki i inkubuj przez 2,5 godziny w temperaturze pokojowej z delikatnym wytrząsaniem (1-2 cykle/s) lub przez noc w temperaturze 4°C.
- Odrzuć roztwór i przepłucz 4 razy zgodnie z zaleceniami w kroku 3.
- Dodaj 100 μL przygotowanego roztworu HRP-Streptawidyna do każdej studzienki. Inkubować przez 45 minut z delikatnym wytrząsaniem w temperaturze pokojowej. Zaleca się, aby czas inkubacji nie był krótszy ani dłuższy niż 45 minut.
- Odrzuć roztwór i przepłucz 4 razy zgodnie z zaleceniami w kroku 3.
- Dodaj 100 μL jednoetapowego odczynnika substratu TMB (pozycja H) do każdego dołka. Inkubować przez 30 minut w temperaturze pokojowej w ciemności z delikatnym wytrząsaniem (1-2 cykle/s).
- Dodać 50 μL roztworu zatrzymującego (pozycja I) do każdego dołka. Natychmiast odczytać absorbancję przy długości fali 450 nm.
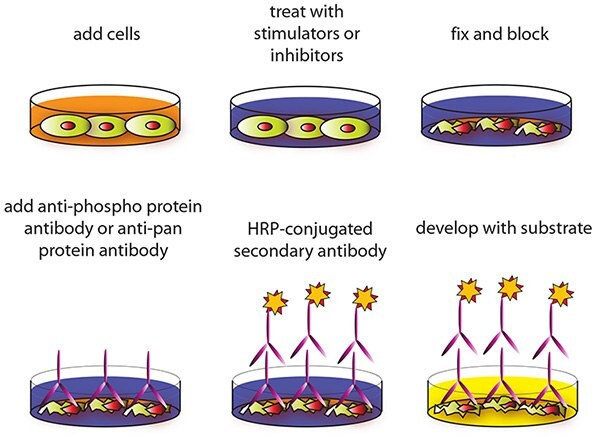
Procedura testu komórkowego
UWAGA: Wszystkie etapy inkubacji i płukania muszą być wykonywane przy delikatnym kołysaniu lub obracaniu (~1-2 cykle/s).
- Zaplanuj eksperyment.
OPCJONALNE: W przypadku wysiewu komórek HUVEC, HMEC-1 lub innych luźno związanych komórek, należy pokryć niepowlekaną 96-dołkową mikropłytkę (ITEM A), dodając 100 μL poli-L-lizyny (zalecany produkt Sigma-Aldrich nr. P4832) do każdej studzienki, a następnie postępuj zgodnie z instrukcjami producenta. Zamiast ITEM A można użyć wstępnie pokrytej płytki CellBIND® mikropłytki lub innej płytki do hodowli tkankowej poddanej działaniu polilizyny. - Nanieść 100 μL od 10 000 do 30 000 komórek do każdej studzienki niepowlekanej 96-dołkowej mikropłytki (ITEM A) i inkubować przez noc w temperaturze 37 °C z 5% CO2.
UWAGA: Optymalna liczba użytych komórek będzie się różnić w zależności od linii komórkowej i względnej ilości fosforylacji białka. Można użyć większej lub mniejszej liczby komórek, ale należy to ustalić empirycznie. UWAGA: Komórki mogą być głodzone ~4-24 godzin (w zależności od linii komórkowej) przed leczeniem inhibitorami lub aktywatorami. - Zastosuj różne zabiegi, inhibitory (takie jak siRNA lub chemikalia) lub aktywatory zgodnie z instrukcjami producenta i inkubuj przez żądane punkty czasowe.
UWAGA: Zaleca się rozpuszczenie inhibitorów lub aktywatorów w wolnym od surowicy podłożu do hodowli komórkowej przed poddaniem komórek działaniu inhibitorów lub aktywatorów (o ile instrukcje producenta nie stanowią inaczej).) - Usuń pożywkę do hodowli komórkowej, odwracając mikropłytkę do góry dnem i delikatnie stukając w dno mikropłytki nad zlewem.
- Przepłucz, pipetując 200 μL przygotowanego 1X buforu płuczącego A (ITEM B) do każdej studzienki. Odrzuć bufor płuczący (tak samo jak w kroku 4) i przepłucz jeszcze 2 razy, w sumie 3 razy, używając za każdym razem świeżego buforu płuczącego. Po ostatnim płukaniu delikatnie osusz mikropłytkę na ręczniku papierowym, aby usunąć nadmiar/resztki buforu.
UWAGA: Aby uniknąć utraty komórek, nie należy pipetować bezpośrednio na komórki. Zamiast tego należy delikatnie dozować płyn w dół ściany dołków hodowli komórkowej. Należy również unikać stosowania odsysania próżniowego lub zbyt mocnego stukania w mikropłytkę podczas usuwania roztworu. - Dodaj 100 μL roztworu utrwalającego (ITEM D) do każdego dołka i inkubuj przez 20 minut w temperaturze pokojowej.
UWAGA: Roztwór utrwalający służy do permeabilizacji komórek. - Powtórzyć etap płukania 5.
- Dodaj 200 μL przygotowanego 1X buforu wygaszającego (ITEM E) do każdej studzienki i inkubuj 20 minut w temperaturze pokojowej.
UWAGA: Bufor wygaszający jest używany w celu zminimalizowania reakcji tła. - Płukać 4 razy 1X buforem płuczącym A.
- Dodaj 200 μL przygotowanego 1X buforu blokującego (ITEM F) do każdej studzienki i inkubuj przez 1 godzinę w temperaturze 37 °C.
- Przepłukać 3 razy przygotowanym 1X buforem płuczącym B (ITEM C).
UWAGA: W razie potrzeby mikropłytkę można przechowywać w -80 °C przez kilka dni po tym płukaniu. - Dodaj 50 μL przygotowanego 1X przeciwciała pierwotnego (ITEM G-1, G-2, G-3, H-1, H-2 lub H-3) do każdego odpowiedniego dołka i inkubuj przez 2 godziny w temperaturze pokojowej.
- Przemyć 4 razy 1X buforem płuczącym B.
- Dodaj 50 μL przygotowanego 1X przeciwciała drugorzędowego sprzężonego z HRP (ITEM I-2) do każdego dołka i inkubuj przez 1 godzinę w temperaturze pokojowej.
- Powtórz krok 13.
- Dodaj 100 μL substratu TMB (ITEM J) do każdego dołka i inkubuj przez 30 minut w temperaturze pokojowej w ciemności.
- Dodaj 50 μL roztworu zatrzymującego (ITEM K) do każdego dołka. Natychmiast odczytać przy długości fali 450 nm.
Produkty
Loading
Zaloguj się, aby kontynuować
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?