Wprowadzenie do przeciwciał: Antygeny, epitopy i przeciwciała
W pierwszej połowie XX wieku seria odkryć naukowych wykazała, że odporność za pośrednictwem przeciwciał jest kamieniem węgielnym specyficznej odpowiedzi immunologicznej. Od czasu ich pierwszego użycia jako narzędzi badawczych do znakowania immunologicznego we wczesnych latach 70-tych, technologie przeciwciał uległy znacznej poprawie, a przeciwciała stały się kluczowymi narzędziami w większości dziedzin badań nauk przyrodniczych. Podstawową zasadą każdej techniki immunochemicznej jest to, że specyficzne przeciwciało łączy się ze swoim specyficznym antygenem w celu wytworzenia wyłącznego kompleksu przeciwciało-antygen. Na kolejnych stronach omówimy naturę tego wiązania oraz wykorzystanie tego solidnego i specyficznego wiązania jako znacznika molekularnego do badań.
Antygeny
Termin antygen pochodzi od generacji przeciwciał, odnosząc się do każdej substancji, która jest w stanie wywołać odpowiedź immunologiczną (np. produkcję określonych cząsteczek przeciwciał). Z definicji, antygen (Ag) jest zdolny do łączenia się ze specyficznymi przeciwciałami powstałymi w wyniku jego obecności.
Ogólnie, antygeny są obcymi białkami lub ich fragmentami, które dostają się do organizmu gospodarza poprzez infekcję. Jednak w niektórych przypadkach własne białka organizmu mogą działać jako antygeny i wywoływać odpowiedź autoimmunologiczną. Bakterie i wirusy zawierają antygeny, zarówno na swojej powierzchni, jak i wewnątrz. Antygeny te mogą być izolowane i wykorzystywane do opracowywania szczepionek.
Antygeny mają zazwyczaj wysoką masę cząsteczkową i zwykle są białkami lub polisacharydami. Polipeptydy, lipidy, kwasy nukleinowe i wiele innych materiałów może również funkcjonować jako antygeny. Odpowiedzi immunologiczne mogą być również generowane przeciwko mniejszym substancjom, zwanym haptenami, jeśli są one chemicznie sprzężone z większym białkiem nośnikowym, takim jak albumina surowicy bydlęcej, hemocyjanina limpetowa (KLH) lub inne syntetyczne matryce. Różne cząsteczki, takie jak leki, cukry proste, aminokwasy, małe peptydy, fosfolipidy lub trójglicerydy mogą działać jako hapteny. W ten sposób, mając wystarczająco dużo czasu, prawie każda obca substancja zostanie zidentyfikowana przez układ odpornościowy i wywoła produkcję specyficznych przeciwciał. Jednak ta specyficzna odpowiedź immunologiczna jest bardzo zmienna i zależy w dużej mierze od wielkości, struktury i składu antygenów. Białka lub glikoproteiny są uważane za najbardziej odpowiednie antygeny ze względu na ich zdolność do generowania silnej odpowiedzi immunologicznej; innymi słowy, są one silnie immunogenne. Antygeny są rozpoznawane przez organizm gospodarza w dwóch różnych procesach (1) przez limfocyty B i ich przeciwciała powierzchniowe (sIgM) oraz (2) przez receptor limfocytów T. Chociaż zarówno komórki B, jak i T reagują na ten sam antygen, reagują na różne części tej samej cząsteczki. Przeciwciała na powierzchni komórek B mogą rozpoznawać trzeciorzędową strukturę białek. Z drugiej strony, limfocyty T wymagają antygenów, które zostały połknięte i zdegradowane do rozpoznawalnych fragmentów przez komórki prezentujące antygen. Powszechnie stosowanymi komórkami prezentującymi antygen są makrofagi i komórki dendrytyczne. Odpowiedź immunologiczną zilustrowano na rysunku 1. Aby uzyskać więcej szczegółów na temat naturalnego procesu produkcji przeciwciał, należy zapoznać się z odpowiednim podręcznikiem immunologii.
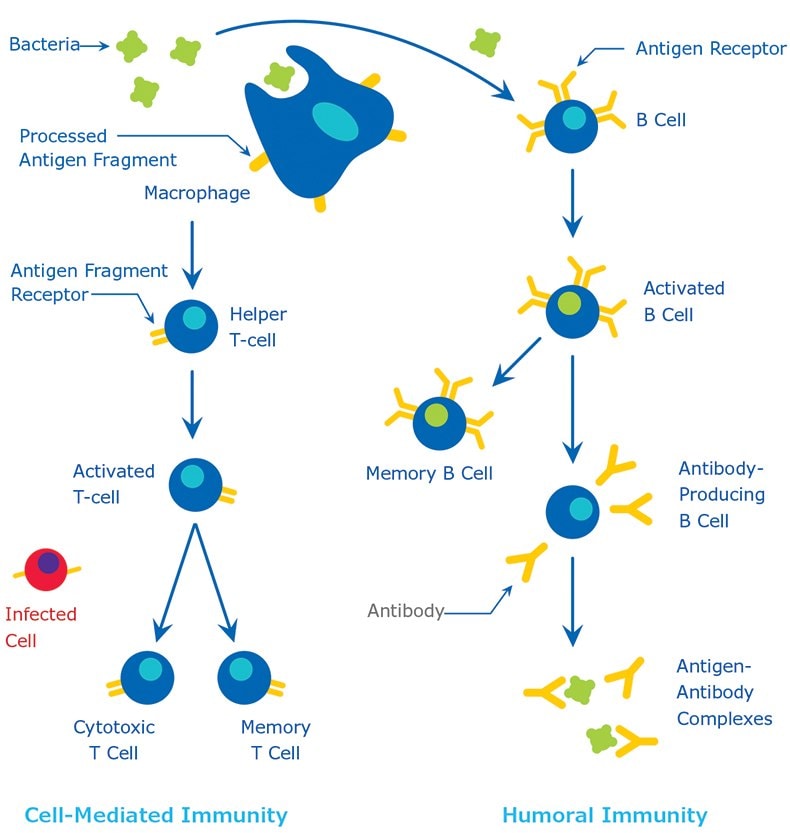
Rysunek 1.Odpowiedź immunologiczna.
Epitopy
Niewielkie miejsce na antygenie, z którym przeciwciało komplementarne może się specyficznie wiązać, nazywane jest epitopem lub determinantą antygenową. Zwykle jest to od jednego do sześciu monosacharydów lub od pięciu do ośmiu reszt aminokwasowych na powierzchni antygenu. Ponieważ cząsteczki antygenu istnieją w przestrzeni, epitop rozpoznawany przez przeciwciało może zależeć od obecności określonej trójwymiarowej konformacji antygenu (np. unikalnego miejsca utworzonego przez interakcję dwóch natywnych pętli lub podjednostek białka). Jest to znane jako epitop konformacyjny. Epitop może również odpowiadać prostej liniowej sekwencji aminokwasów i takie epitopy są znane jako epitopy liniowe.
Zakres możliwych miejsc wiązania na cząsteczce docelowej (antygenie) jest ogromny, a każde potencjalne miejsce wiązania ma swoje własne właściwości strukturalne wynikające z wiązań kowalencyjnych, wiązań jonowych, oddziaływań hydrofilowych i hydrofobowych. Rzeczywiście, ma to istotne konsekwencje dla wyboru przeciwciała i jego skuteczności. Aby doszło do skutecznej interakcji między docelowym antygenem a przeciwciałem, epitop musi być łatwo dostępny do wiązania.
Jeśli docelowa cząsteczka jest denaturowana, np. poprzez utrwalanie, redukcję, zmiany pH lub podczas przygotowywania do elektroforezy żelowej, epitop może zostać zmieniony, co może wpłynąć na jego zdolność do interakcji z przeciwciałem. Na przykład, niektóre przeciwciała są nieskuteczne w Western blotting (WB), ale nadają się do zastosowań immunohistochemicznych (IHC), ponieważ w procedurze IHC złożone miejsce antygenowe może być zachowane w tkance, podczas gdy w procedurze WB proces przygotowania próbki zmienia konformację białka w stopniu wystarczającym do zniszczenia miejsca antygenowego, a tym samym eliminuje wiązanie przeciwciała. Dlatego w protokołach, w których stosuje się zdenaturowane białko, takich jak Western blotting, preferowane jest przeciwciało rozpoznające epitop liniowy. Czasami epitop znajduje się wewnątrz pofałdowanego białka. Epitop jest wtedy niedostępny dla przeciwciała w protokole niedenaturującym, takim jak immunoprecypitacja. Epitop konformacyjny z definicji znajduje się na zewnątrz pofałdowanego białka. Przeciwciało rozpoznające epitop konformacyjny jest odpowiednie dla łagodnych, niedenaturujących procedur, takich jak immunoprecypitacja lub cytometria przepływowa.
Optymalnie, przeciwciało rozpoznające liniowy epitop na powierzchni normalnie sfałdowanego białka będzie dobrze działać zarówno w protokołach niedenaturujących, jak i denaturujących. Tak więc epitop może być obecny w natywnym, komórkowym środowisku antygenu lub może być odsłonięty tylko po denaturacji. W swojej naturalnej postaci antygeny mogą być cytoplazmatyczne (rozpuszczalne), związane z błoną lub wydzielane. Liczba, lokalizacja i rozmiar epitopów zależą od tego, jak duża część antygenu jest prezentowana podczas procesu tworzenia przeciwciał.
Wiedza na temat białka docelowego, epitopu rozpoznawanego przez przeciwciało, zachowania sekwencji i zasad techniki są cenne w dokonywaniu dobrych wyborów przeciwciał i protokołów. Rzeczywiste mapowanie epitopu lub dane sekwencji, choć przydatne, nie są jednak potrzebne, aby mieć pewność co do swoistości przeciwciała.

Rysunek 2.Aminokwasy tworzące białko.
Przeciwciała
Przeciwciało definiuje się jako "immunoglobulinę zdolną do specyficznego łączenia się z antygenem, który spowodował jego wytworzenie u podatnego zwierzęcia." Przeciwciała są wytwarzane w odpowiedzi na inwazję obcych cząsteczek w organizmie. Przeciwciało, w skrócie Ab, jest powszechnie określane jako immunoglobulina lub Ig. Ludzkie immunoglobuliny to grupa strukturalnie i funkcjonalnie podobnych glikoprotein (82-96% białka i 4-18% węglowodanów), które nadają odporność humoralną.
Struktura
Przeciwciała istnieją jako jedna lub więcej kopii jednostki w kształcie litery Y, składającej się z czterech łańcuchów polipeptydowych. Każdy Y zawiera dwie identyczne kopie łańcucha ciężkiego i dwie identyczne kopie łańcucha lekkiego, nazwane tak ze względu na ich względną masę cząsteczkową. Ta jednostka w kształcie litery Y składa się z dwóch zmiennych, specyficznych dla antygenu ramion F(ab), które są krytyczne dla rzeczywistego wiązania antygenu, oraz stałego "ogona" Fc, który wiąże receptory Fc komórek odpornościowych, a także służy jako użyteczny "uchwyt" do manipulowania przeciwciałem podczas większości procedur immunochemicznych. Liczba regionów F(ab) na przeciwciele odpowiada jego podklasie (patrz poniżej) i określa wartościowość przeciwciała (luźno mówiąc, liczbę "ramion", z którymi przeciwciało może wiązać swój antygen).

Rysunek 3.Struktura przeciwciała.
Te trzy regiony mogą zostać rozszczepione na dwa fragmenty F(ab) i jeden fragment Fc przez enzym proteolityczny, papainę, lub tylko na dwie części: jedną F(ab')2 i jedną Fc w regionie zawiasowym, przez pepsynę. Fragmentacja przeciwciał IgG jest czasami przydatna, ponieważ fragmenty F(ab) nie wytrącają antygenu i nie są wiązane przez komórki odpornościowe w badaniach na żywo z powodu braku regionu Fc.
Podklasy przeciwciał
Przeciwciała można podzielić na pięć klas: IgG, IgM, IgA, IgD i IgE, w oparciu o liczbę jednostek Y i typ łańcucha ciężkiego. Łańcuchy ciężkie IgG, IgM, IgA, IgD i IgE są znane odpowiednio jako g, µ, a, d i e. Łańcuchy lekkie każdego przeciwciała można sklasyfikować jako typ kappa (κ) lub lambda (λ) (na podstawie niewielkich różnic strukturalnych polipeptydów); jednak łańcuch ciężki określa podklasę każdego przeciwciała.
Podklasy przeciwciał różnią się liczbą wiązań dwusiarczkowych i długością regionu zawiasowego. Najczęściej stosowanym przeciwciałem w procedurach immunochemicznych jest klasa IgG, ponieważ jest to główna klasa immunoglobulin uwalnianych w surowicy.
IgA
W krwi IgA występują w niskich poziomach w postaci monomerycznej. Są one najbardziej aktywne na powierzchniach błon śluzowych, gdzie występują w postaci dimerycznej i zapewniają podstawową obronę na powierzchniach błon śluzowych. W błonach śluzowych produkowanych jest więcej IgA niż wszystkich innych rodzajów przeciwciał razem wziętych. Jego główną funkcją jest działanie jako przeciwciało neutralizujące. Wysokie poziomy IgA są obecne w ślinie, łzach i mleku matki. U ludzi znane są dwa podtypy IgA, podczas gdy u myszy odnotowano tylko jedną formę. IgA1 może stanowić do 85% całkowitej IgA w surowicy. Selektywny niedobór IgA jest jedną z najczęstszych chorób niedoboru odporności, która zwiększa podatność na infekcje. Niedobory IgA są często obserwowane u pacjentów z chorobami autoimmunologicznymi i zaburzeniami alergicznymi. Okres półtrwania IgA wynosi około 5 dni.
IgD
Jest to monomeryczne przeciwciało z dwoma miejscami wiązania epitopów i znajduje się na powierzchni większości limfocytów B. Jego dokładna funkcja jest nadal przedmiotem dyskusji. Jego dokładna funkcja jest nadal kwestionowana, ale sugeruje się, że działa jako receptor antygenu wymagany do aktywacji komórek B. IgD wiąże się również z bazofilami i komórkami tucznymi i aktywuje je do produkcji czynników przeciwdrobnoustrojowych. Uważa się również, że odgrywa rolę w eliminacji limfocytów B, które wytwarzają autoprzeciwciała. IgD jest również wytwarzana w postaci wydzielanej, która znajduje się w surowicy w niewielkich ilościach i zawiera dwa łańcuchy ciężkie klasy δ i dwa łańcuchy lekkie. Okres półtrwania IgD wynosi około 3 dni.
IgE
Ta grupa przeciwciał jest skuteczna na powierzchniach błon śluzowych, krwi i tkankach. Występuje jako monomer składający się z dwóch łańcuchów ciężkich (łańcuch ε) i dwóch łańcuchów lekkich. Łańcuch ε zawiera 4 stałe domeny Ig-podobne. W surowicy występuje w niskich stężeniach, stanowiąc jedynie około 0,002% wszystkich przeciwciał w surowicy. Większość IgE jest ściśle związana z receptorami na komórkach tucznych i bazofilach poprzez region Fc. Odgrywa kluczową rolę w reakcjach nadwrażliwości, a jej produkcja jest ściśle kontrolowana przez cytokiny. Okres półtrwania IgE wynosi około 2 dni.
IgG
Jest to najliczniejsza klasa przeciwciał we krwi, obejmująca do 80% wszystkich przeciwciał w surowicy. Występuje w postaci monomerycznej. Opisano cztery podklasy IgG w zależności od ich obfitości (IgG1> IgG2> IgG3> IgG4), a wytwarzana podklasa zależy od rodzaju obecnej cytokiny.
IgG1 i IgG3 wykazują wysokie powinowactwo do receptorów Fc na fagocytach, podczas gdy IgG2 wykazuje bardzo niskie powinowactwo, a IgG4 ma umiarkowane powinowactwo do receptorów Fc IgG są zdolne do opuszczenia układu krążenia i dostania się do tkanek. IgG1, IgG3 i IgG4 mogą przekraczać barierę łożyskową, zapewniając ochronę noworodkom. IgG skutecznie aktywują układ dopełniacza i są bardzo skuteczne w opsonizacji przy użyciu receptorów Fc na fagocytach. Poprzez swój region Fc IgG mogą również wiązać się z komórkami naturalnych zabójców i uczestniczyć w cytotoksyczności zależnej od przeciwciał. Okres półtrwania IgG wynosi od 7 do 23 dni, w zależności od jej podklasy.
IgM
Ta klasa immunoglobulin jako pierwsza jest wytwarzana w odpowiedzi na infekcję i znajduje się albo na błonach komórek B, albo jako 5-podjednostkowa makrocząsteczka wydzielana przez komórki plazmatyczne. Jest to również pierwsza klasa immunoglobulin syntetyzowana przez noworodki. Powierzchniowa IgM różni się od formy wydzielanej regionem Fc. Powierzchniowa IgM wiąże się bezpośrednio jako integralne białko błonowe, a nie z receptorem IgM Fc. Wydzielana IgM jest cząsteczką pentameryczną, w której wiele immunoglobulin jest kowalencyjnie połączonych wiązaniami dwusiarczkowymi. Struktura ta zapewnia wiele miejsc wiązania. Każdy monomer składa się z dwóch łańcuchów lekkich (κ lub λ) i dwóch łańcuchów ciężkich. Ze względu na swoją pentameryczną naturę IgM szczególnie nadaje się do aktywacji dopełniacza i wywoływania aglutynacji. Okres półtrwania IgM wynosi około 5 dni.

Rysunek 4.Przeciwciała zawierające tylko łańcuch ciężki.
Ciężkołańcuchowe przeciwciało rekina (IgNAR) i ciężkołańcuchowe przeciwciało wielbłąda (hclgG) w porównaniu do zwykłego przeciwciała (IgG). Ciężkie łańcuchy są pokazane w ciemniejszym odcieniu, lekkie łańcuchy w jaśniejszym odcieniu.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?