アルカリホスファターゼ
アルカリホスファターゼ — アッセイ、分子量、基質、および構造
ELISA、ウエスタンブロット、組織化学的検出を目的とした、各種抗体や他のタンパク質との結合に最適化されたアルカリホスファターゼ(ALP/ALKP)製剤を幅広くご提供しています。BioUltraグレードのアルカリホスファターゼは比活性が非常に高く、高感度が必要となるタンパク質標識に特に役立ちます。
ウェスタンブロッティング

図1.抗FLAG抗体およびALP標識二次抗体と反応させ、BCIP/NBT基質により発色させたFLAG-BAPコントロールタンパク質(ProteoQuest比色ウエスタンブロットキット、B6404を使用)。
免疫組織化学
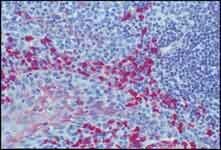
図2.SIGMAFAST™ Fast Red TR/ナフトールAS-MXタブレット(カタログ番号 F4523)を基質として使用して、モノクローナル抗ヒトIgAと抗マウスIgG ALPコンジュゲートで染色されたヒト扁桃腺のホルマリン固定パラフィン包埋切片。。40x
メルクの製品は、カゼイン等のタンパク質の脱リン酸化にも使用されています。ALKPは、セルフライゲーションを防止するためにDNAまたはRNAの5'末端を脱リン酸化するために使用できます。DNAまたはRNAは、ALKPで脱リン酸化した後、(T4ポリヌクレオチドキナーゼを使用して)放射性標識リン酸でタグ付けすることもできます。
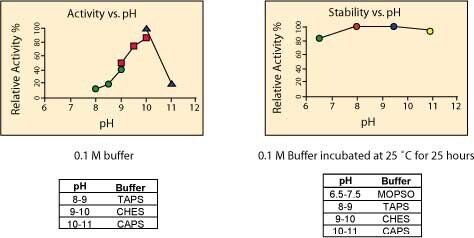
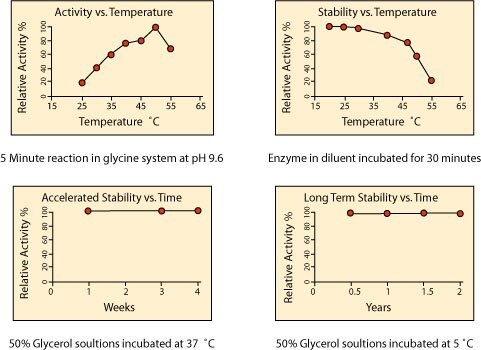
活性と安定性に対する温度の影響
ウシ由来アルカリホスファターゼ阻害剤
キレート剤、ヒ酸塩、システイン、ヨウ素、無機リン酸塩、ピロリン酸塩、リン酸ジイソプロピル、トリフェニルリン酸塩、フルオロリン酸ジイソプロピル、およびL-フェニルアラニン。9,10
レバミゾール(カタログ番号 L9756)は通常、腸内酵素をわずかに阻害すると同時に、内因性ALKP活性を阻害する目的で使用されます。11,12
アッセイプロトコル
- ジエタノールアミンアッセイ
- グリシンアッセイ pH 8.8
- グリシン亜鉛アッセイ
- グリシンアッセイ pH 10.4
ユニット定義:1 DEAユニットは、pH9.8および37℃の条件下で毎分1マイクロモルの4-ニトロフェニルリン酸を加水分解します。1グリシンユニットは約3 DEAユニットに相当します。
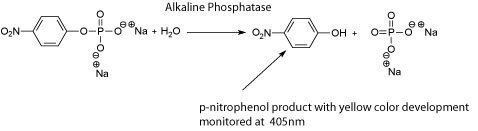
ALPは、牛乳やチーズなどの乳製品に対する低温殺菌の効果を測定するためにも使用されます。ALPは、約72℃の温度に15秒以上さらされると変性します。それほど極端でない温度条件でも、大半の牛乳由来病原体が破壊されることがわかっています。そのため、ALP活性は、低温殺菌の効果を測定するために使用できます。これまで、低温殺菌後のALP活性を調べるために、2通りの方法が用いられてきました。最初の方法は、フェノールを遊離して測定するScharer検査です。2番目の方法は、Aschaffenberg & Mullen検査と呼ばれ、p-ニトロフェノールの放出量を測定します。両方の検査で陰性の結果が出た場合は、ALP活性がなく、大半の牛乳由来病原体が破壊されていることを意味します。これと同じALP活性原理に基づいて、より感度の高い新しい手法が最近開発されました。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?