はじめに
PLGA、ポリ乳酸、ポリカプロラクトンをはじめとする生分解性ポリマーのマイクロスフェアおよびナノ粒子は、ドラッグデリバリーの用途で広く利用されています。医薬品有効成分(API:active pharmaceutical ingredient)が低分子または生体化合物のいずれであっても、マイクロスフェアおよびナノ粒子にカプセル化することで、ドラッグデリバリーの徐放化や標的化、APIの分解防止などの用途に利用することが可能です。現在、PLGAマイクロスフェアに薬剤を充填した複数の製剤が上市されています。例として、リュープロレリン酢酸塩をPLGAマイクロスフェアでカプセル化したLupron Depot®が、前立腺がんおよび子宮内膜症に対して使用されており、1か月、3か月、4か月間隔での皮下投与が行われています。
薬剤を充填したPLGAマイクロスフェアを投与すると、生体内でPLGAポリマーのエステル骨格の加水分解が始まり、無害な化合物が生成します。さらにPLGAが分解するにつれて、薬物分子がマイクロスフェアから徐々に放出されます。PLGAポリマーの種類とカプセル化の方法を調節することで、薬物の放出速度を変えることができます。例として、以下のパラメータを用いて薬物の放出プロファイルを調節が可能です。
- PLGAポリマーのラクチドとグリコリドの比率(L/G比):例えばL/G比が50:50の場合に薬物放出が最も速くなります。
- PLGAポリマーの分子量またはインヘレント粘度:分子量が大きいと薬物放出が遅くなります。
- PLGAポリマーの末端基:PLGAポリマーの末端がカルボキシ基の場合、末端がエステル基の場合と比較して薬物放出が速くなります。
Degradex® PLGA粒子
Degradex® PLGAマイクロスフェアおよびナノ粒子は、ナノメートルからマイクロメートルの範囲のサイズを持つポリマー粒子であり、蛍光色素を含まない(plain)粒子と蛍光色素を含有した粒子が入手可能です。色素不含有のPLGAマイクロスフェアおよびナノ粒子は、調整剤としてDDS研究や製剤に使用でき、APIを担体に充填する前のシステム適合性試験にも利用できます。蛍光性ナノ粒子およびマイクロスフェアは、イメージングや診断の用途において、結合イベントの検出やシグナル増幅に使用できます。さらに、流体追跡、細胞追跡、食作用研究、蛍光顕微鏡、DDS研究にも蛍光性粒子を使用することができます。

図1APIを充填したPLGAマイクロスフェアの画像
表面結合用Degradex® PLGA粒子
Degradex® PLGA粒子は、粒子表面に薬物分子を結合させて送達する担体としても使用できます。色素不含有および蛍光性粒子の表面はカルボキシ基で修飾されているため、タンパク質、ペプチド、抗体、抗原、および低分子化合物との共有結合的な結合が可能です。薬物を結合させたDegradex®粒子は以下の用途で使用できます。
- 腫瘍などの特定部位の標的化1,2
- 細胞内への侵入促進3
- 血液脳関門の通過促進4
- 溶解度および生物学的利用能の向上5
- 血漿中の循環時間の延長(通常、PEG化PLGAナノ粒子を使用)6
Degradex® PLGA粒子の取り扱いと使用方法
1. 再構成
Degradex®マイクロスフェアは、通常、凍結乾燥した粉末状で梱包されています。多くの用途において、脱イオン水やバッファーなどの水性媒体で粒子を再構成する必要があります。使用前に粒子をよく懸濁させて、粒子の凝集がない単粒子分散液にすることが重要です。Degradex®粒子を再分散させるための推奨プロトコールを以下に示します。
1. 容器を冷凍庫から取り出し、室温に戻します。
2. 脱イオン水またはバッファーを容器に加えます。
3. 内容物を緩やかに混合し、粒子をよく分散させます。必要に応じて、ボルテックスまたは超音波処理を行います。
2. 粒子サイズの測定
Degradex® PLGA粒子のサイズとその分布は、レーザー回折法、沈降法、水簸法、顕微鏡法、コールター法、動的光散乱法、および粒子画像解析法などを用いて測定されます。マイクロスフェアの粒子サイズ測定にはレーザー回折法およびコールター法が一般に使用され、ナノ粒子に対しては動的光散乱法がよく用いられます。
例として、レーザー回折式粒径測定法によるPLGAマイクロスフェア(805122)の代表的な粒子サイズのグラフを図2に示します。また、動的光散乱測定法で測定したPLGAナノ粒子(805211)の粒子サイズと代表的なグラフの例を図3に示します。
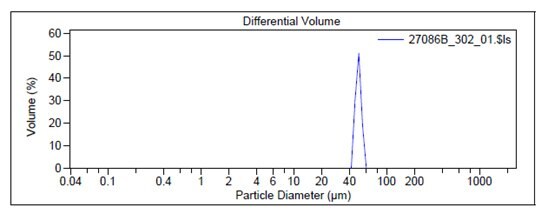
図2レーザー回折法で測定したマイクロスフェア(805122)の粒径
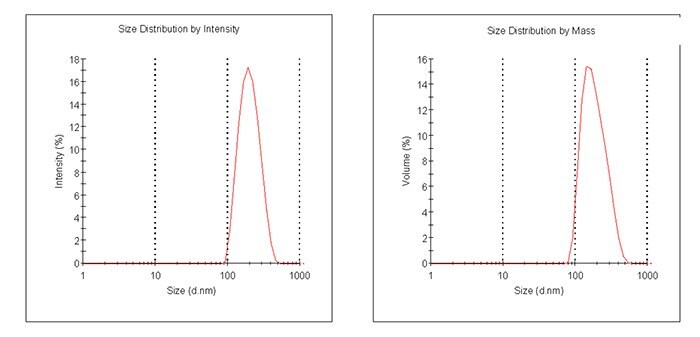
図3動的光散乱法で測定したナノ粒子(805211)の粒径
3. 粒子表面への結合
Degradex® PLGA粒子の表面にはカルボキシ基が存在するため、生体化合物のアミノ基と反応させて共有結合を作ることができます。以下のプロトコールは、生体分子をDegradex® PLGA粒子に結合させるための一般的なガイドラインとなります。なお、期待される反応性および安定性を得るためには、最適化を行う必要があります。
- 約10 mgのカルボキシル化粒子を、1.5~2 mLのポリプロピレン製マイクロ遠心チューブに入れます。50 mM MESバッファー(pH 5.2)を0.2 mL加え、ボルテックスミキサーでマイクロスフェアを分散させます。
必要に応じて超音波処理を行います。 - 10 mgのEDC(E1769)を50 μLの50 mM MESバッファー(pH 5.2)に溶かして200 mg/mLのEDC溶液を調製し、直ちに使用します。
- 調製したEDC溶液20 μLをマイクロスフェア分散液に加えます。
- 緩やかに回転させながら混合します。
- 200~500 μg相当の生体分子を加えます。ゆっくり回転させるか、短時間のボルテックス撹拌により混合します。
- 穏やかに撹拌しながら、室温で2~4時間インキュベートします。
- 混合物を10分間、適切な加速度(G)で遠心機にかけます。注記:粒子のペレット化に必要な実際のG値は、粒子径に依存します。
結合した生体分子の定量のために上澄み液を保存します。 - マイクロスフェアのペレットを、0.05% BSA(pH 8.0)を含む0.4 mLの10 mM トリスバッファーに再懸濁させます。
- 手順7~8を繰り返し、結合した生体分子の定量に用いる上澄み液を合わせます。
- 接合させたマイクロスフェアは、4℃の保存用トリスバッファー中で保管します。PLGAは分解性を有するため、結合させた粒子はできるだけ早く使用する必要があります。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?