光架橋性ゼラチンハイドロゲル:高分解能付加製造向けの多用途性材料
Jasper Van Hoorick<sup>1,2</sup>, Aleksandr Ovsianikov<sup>3,4</sup>, Peter Dubruel<sup>1</sup>, Sandra Van Vlierberghe<sup>1,2</sup>
Material Matters 2018, Vol.13 No.3
はじめに
ゼラチンは、組織工学の分野で長年にわたって関心を集めています。ゼラチンは天然の細胞外マトリックス(ECM:extracellular matrix)の主成分であるコラーゲンに由来し、細胞中のタンパク質骨格のアルギニン-グリシン-アスパラギン酸配列を認識して相互作用し、酵素分解性もあります1。ゼラチンは食肉生産の副生成物として製造されるため、対費用効果が非常に高く2、食品産業や医薬品産業での長年にわたる歴史を受けてアメリカ食品医薬品局(FDA:the Food and Drug Association)に安全とみなされています3。
ゼラチンの上限臨界溶解温度(UCST:upper critical solution temperature)は約30~35℃です。すなわち、この温度以上では水に溶解し、これより低温ではハイドロゲルを生成します4–6。このように温度による形態変化を利用して、押出成型による迅速製造技術が適用でき、加熱したノズルから低温の環境に押し出すことで目的の成型が可能です7。
ただし、この性質は、生理学的または細胞培養の条件で材料が不安定になり得ることも意味します。その結果、ゼラチンは当初、以下の二つの応用にのみ用いられていました。第一が、細胞をより直接的に操作できるようにするための一時的な細胞担体としての利用です。第二は、(ヒドロキシ)リシンやオルニチン残基に含まれる第一級アミンのアスパラギン酸およびグルタミン酸残基のカルボキシ基と結合させる(それにより架橋ハイドロゲルネットワークを得る)か、またはグルタルアルデヒドを用いて求核基を架橋することで、ゼラチンを安定化することも行われていました。これらいずれの方法でも、3D構造の設計を十分に制御することはできません3,8,9。
幸いなことに、ゼラチン安定化の方法は2000年に大きな飛躍を迎えました。私たちの研究グループは、光架橋性を持つ初のゼラチン誘導体であるゼラチン-メタクリルアミド(Gel-MOD:gelatin-methacrylamide)を開発して特許を取得し、簡便かつ直接的な成形加工を可能にしました6,10。ゼラチンの(ヒドロキシ)リシンおよびオルニチンの側鎖にある第一級アミンとメタクリル酸無水物の反応により、メタクリルアミドが導入されます6。このゼラチン-メタクリルアミドが開発されて以降、非常に多数のバイオファブリケーション法に取り入れられており、この分野のゴールドスタンダードとみなされています4,7,11–17。このアカデミア発の材料は、現在では複数の企業がバイオファブリケーション用バイオインクとして市販しています18–20。
その後、バイオファブリケーションに適した複数の光架橋性ゼラチン誘導体(図1)が他にも登場しています。これら誘導体は、架橋反応の機構が連鎖重合と逐次重合のどちらで進むかによって、2種類に大別することができます。本稿では、高分解能の付加製造(additive manufacturing、AM、3Dプリンティング)を含むバイオファブリケーションに向けた光架橋性誘導体を中心に紹介します。

図1様々な光架橋性ゼラチン調製法の概要:連鎖重合型誘導体(灰色、上枠):A)ゼラチン-メタクリルアミド(Gel-MOD)6、B)ゼラチン-アクリルアミド(Gel-AA)21、C)Gel-MOD-AEMA5、逐次重合型誘導体(紫、下枠)、D)カルブ酸無水物との反応で合成されたゼラチン-ノルボルネン(Gel-NB)1、E)5-ノルボルネン-2-カルボン酸との反応で合成されたゼラチン-ノルボルネン(Gel-NB)22、F)ゼラチン-ビニルエステル(Gel-VE)23、G)アリル化ゼラチン(Gel-AGE)24。
架橋の機構
連鎖重合による架橋
架橋性ゼラチンを得る主たる方法は、連鎖重合による架橋法です。この機構では、ゼラチン鎖上に固定された反応性の官能基(通常はアクリル酸(メタクリル酸)エステルまたはアクリルアミド(メタクリルアミド)が互いに重合し、ゼラチン鎖の間に短鎖のオリゴマーまたはポリマーが形成されます(図2AおよびC)5,6,11,21,22。この作製法は非常に簡便で、架橋の前に材料を溶解して、適切な光開始剤を添加するだけです。架橋剤は不要です。pH 8.5での半減期が0℃での11時間から、40℃では0.2時間まで短くなってしまう(以下で議論します)チオール-エン系よりも、これらの溶液はUCST以上の温度で安定性が高いという利点があります。例えばGel-MODでは、40℃で24時間以上問題なく保存できます。通常、付加製造の工程や細胞カプセル化実験ではこのレベルの安定性が必要になります5,25。さらに、連鎖重合による架橋では剛性の高いハイドロゲルが得られます(図3)22。連鎖重合による架橋法の欠点の1つは、形成されるネットワークがより不均一になり、架橋の間に収縮しやすくなるということです。さらに、拡散の制限、鎖長の問題、および停止反応に至る拡散の制限のためにフリーラジカル重合の速度論はより複雑であり、反応する官能基の数を制御することが困難です26,27。また、架橋反応が酸素阻害を受けやすいため、細胞カプセル化実験の用途では問題が生じ、反応の再現性に影響します。最後に、以下に議論するチオール-エン系の逐次重合型ハイドロゲルと比較して、ゼラチンの架橋に必要な時空間的なエネルギーが大きくなります22。
逐次重合による架橋
第二の光架橋性ハイドロゲルは、ハイドロゲル内に架橋を導入するために逐次重合を使用するものです。逐次重合の生長反応は、理想的には相互にしか反応できない相補的な2つの反応基の間で起こります27。この機構による化学的架橋方法としてハイドロゲルに最も一般的に使用されているのは、チオール-エン系のフォトクリックケミストリーです(図2B)。この方法では、光誘起のラジカル媒介チオール-エン反応、ないしはアニオン種の生成によるチオールのマイケル付加反応のいずれかでチオールをエン官能基と反応させることでネットワークを形成します27。光誘起反応は、通常光開始剤の有無にかかわらず、チオール由来のラジカルの生成と続くエン種の二重結合との反応によって進行します(図2B)27。一般に、立体障害がなければどのようなエン官能基とも反応は十分に進行しますが、重合連鎖重合が競合して起きないエン官能基(ノルボルネン、ビニルエーテルなど)27が好まれます。また、このために反応を十分に制御でき、生成されるネットワークの均一性もそれに伴い向上します27。チオール-エン光架橋性ゼラチンを得るためには、多官能性チオール化架橋剤(DTT:dithiothreitolなど)で架橋可能なエン官能基(通常はノルボルネン、ビニルエーテルまたはアリルエーテル)を含んでいる必要があります(図2C)1,22–24。別の方法として、ゼラチンをチオールで修飾したあとに多官能性のエン架橋剤(ポリ(エチレングリコール)ジアクリラート:PEGDAなど)28,29で架橋を行うことも可能です。
チオール-エン系の「フォトクリック」ハイドロゲルは、連鎖重合に基づくハイドロゲルと比較して反応の直交性が高いため、ネットワークがより均一になり、収縮も小さくなります30。さらに、酸素による阻害を受けず、一般に反応速度が速くなります(例えば、ゲル化点はGel-NB + DTTで2.7秒に対してGel-MODでは64.7秒)22,27,30。ノルボルネン官能基を用いると、反応の際にノルボルネン環の歪みが解放されることによる「ばね仕掛け」に加えて、炭素中心ラジカルによるチオール-水素引き抜き反応の速度が速いため、架橋の速度が最も速くなります1,24,31。また、架橋前のチオール-エンの比率を変えることで、反応性官能基の割合を完全に制御できます22,27,30。一般に、連鎖重合によるハイドロゲル系と比較して、チオール-エン系ではラジカル種の濃度が少なくとも1桁低いため、細胞のカプセル化にはチオール-エン系が適しています、(連鎖重合系では酸素による阻害を克服するためより多くのラジカルを必要とします)1,30,32。逐次重合法の欠点として、反応混合物に多官能チオール系架橋剤を添加する必要があり、他のチオールと交差反応してジスルフィドが生成してしまうことが挙げられます26。高温では、経時的なジスルフィドの生成の確率が上がります(例えば、pH 8.5におけるDTTの半減期は0℃で11時間ですが、40℃では0.2時間になります)。バイオプリンティングではゼラチンの溶解度を維持するために高温が必須になるので、これは非常に困難な問題になります25。さらに、逐次重合型ハイドロゲルは対応する連鎖重合型ハイドロゲルと比較して、一般に貯蔵弾性率が大幅に低くなります1,22。

図2連鎖成長による架橋(Gel-MOD)vs. チオール-エン・フォトクリックケミストリーを使用した段階成長による架橋(Gel-NB + DTT)の図解。許可を得て文献22より転載。copyright 2018 Wiley。
光架橋性ゼラチンの機械的性質の制御
光架橋性ゼラチンハイドロゲルの機械的性質は、ゼラチン自体や材料の成形加工法の様々なパラメータを調節することで制御できます。
化学的修飾による機械的性質への影響
架橋性官能基の数は、材料の最終的な機械的性質に大きく影響します4,5。多くの誘導体の場合、反応する第一級アミンの数とそれに従う置換度は、官能化剤(例えば、メタクリル酸無水物4、カルブ酸無水物1、5-ノルボルネン-2-カルボン酸22など)のモル比をゼラチン中に存在する第一級アミンの数に合うように変えることで制御できます。すべての第一級アミンが架橋性の官能基に変換されている場合、2-アミノエチルメタクリラートのような追加の架橋性官能基でアスパラギン酸とグルタミン酸の側鎖のカルボン酸を修飾すると、機械的性質をさらに向上させることができます5。その結果、最高で剛性が5倍高いハイドロゲルが得られます5。また、ゼラチン-メタクリルアミドの機械的性質は、架橋前にアルギン酸のようなバイオポリマーと共有結合させることでも調節できます33。この方法で得たハイドロゲルブレンドの強度は純粋なゼラチン-メタクリルアミドより低くなりますが、二価のカチオンを組み込んでアルギン酸鎖を物理的に架橋することで、最終的な機械的性質をより微細に制御できます33。さらに、タンパク質と多糖類の鎖で架橋のネットワークが形成されるため、ECMをより正確に模倣したハイドロゲルが得られます33。
ハイドロゲル成形加工法の機械的性質への影響
架橋したゼラチンハイドロゲルを合成したあと、その処理中に機械的性質に影響を与える方法が複数あります。例えば、天然(多糖類など)または合成(PEGなど)の別の光架橋性材料と共架橋する方法があります1,34,35。
材料が単独の種類である必要がある場合は、ハイドロゲルの前駆体溶液中のゼラチン濃度を変えることで、最終的なハイドロゲルの機械的性質を調節できます。元のゼラチン濃度が高いほど、より硬いハイドロゲルが得られます4,5,21,22。ただし、ゼラチン濃度が高い(>15 w/v%)と生体適合性に悪影響があることも示唆されています21。
また、架橋の際の照射量も、材料の最終的な機械的性質に影響します5–7,21。一般に、照射量を減らすと、架橋の密度が低下してハイドロゲルが弱くなり7,21、細胞毒性を示す可能性のある未反応の官能基も増加します。さらに、連鎖重合型ハイドロゲルを使用する場合、架橋反応の速度論が複雑であり、また酸素による阻害の影響を受けるため、低照射量では再現性が悪くなる場合も多くあります27。また、反応性の高いチオール-エン系を使用する場合、非常に少ない照射量で材料が完全に架橋されるため照射量の影響は小さいように見えますが、照射エネルギーと膨潤度の間には明らかな相関があります。例えば、2光子重合の際、100 mm/sで20 mWの照射の場合にGel-NBでは40 mW以上で完全に架橋されたネットワークが得られますが、Gel-MODを完全に架橋するには80 mW以上が必要です5,22。

図3様々な架橋ゼラチンハイドロゲル(文献22および24記載のチオール-エン・ハイドロゲルを含む)と様々な組織の機械的性質の比較の概略図。文献5より許可を得て転載。copyright 2017 ACS。元の文献で記述されているハイドロゲルを赤、天然の組織を黒、連鎖重合型ハイドロゲルを灰色、逐次重合型ハイドロゲル系を紫で示しています。
チオール-エン・ハイドロゲル系を使用する場合、最終的な機械的性質をさらに制御することが可能です。チオール-エンの比率を変えることで、反応する官能基の数と最終生成物の機械的性質を微細に制御することができます1,22,27。架橋剤分子あたりの反応性チオールの数が多いと、架橋密度が増加するためハイドロゲルの剛性が高くなります1。
このように多様な制御が可能であることから、幅広い機械的性質を持つゼラチンハイドロゲルの製造が可能です。図3に、網羅的ではありませんが、ゼラチン誘導体と多様な組織の機械的性質を比較した概要図を示します5。この比較からわかるように、ゼラチン系材料は多様な組織の機械的性質を模倣できる極めて万能なツールです。
付加製造によるゼラチンの成形加工
ゼラチンハイドロゲルの成形加工には、直接法と間接法の双方を含む幅広い付加製造法が使用されています。直接法では、付加製造の段階で材料が直接使用され7、間接法では、二次的にハイドロゲル材料の形状を制御するため、付加製造によって作製したテンプレートが使用されます。間接法は、望ましい細胞との相互作用性を持つゼラチンと剛性の高いポリマーとを組み合わせる場合や、直接法では成形加工できない材料に複雑な3D構造を導入するためによく使用されています4,12,15,36。
ここでは光誘起付加製造法、より具体的には、直接レーザー書き込みと呼ばれることも多い2光子重合(2PP:two-photon polymerization)のような、高分解能付加製造法を中心に紹介します。この方法では、非線形の2光子吸収で局所的に架橋を起こすことで、サブマイクロメートルの空間分解能が得られます。フェムト秒レーザー光線を局所に収束させて材料に入射した際に、2光子それぞれが光開始剤を励起するためのバンドギャップエネルギーの半分を持つ同時相互作用の条件が満たされると(図4A)、重合が非常に局所的に起きます5,37,38。さらに、用いた光学系とレーザー出力で決まる非常に小さなボクセルの中だけで2PPの確率が高くなるため、予想される回折限界より小さな3D体積要素に重合が限定されることも少なくありません。これは、従来の1光子(線形)吸収に基づく光付加製造法では、光の透過深度でしか制御できない光路全体で重合が起こることと対照的です5,39。
その結果、2PPは細胞以下の寸法の構造を作製することが可能で、より複雑な細胞-生体材料の相互作用の研究に適しています。私たちは2011年に、この方法による一次脂肪組織由来幹細胞を使用したゼラチン系組織工学足場の作製について初めて報告しました14。
それ以降、2PPによる修飾ゼラチンの成形を扱った複数の研究が報告されており、そのほとんどでGel-MODが使用されています23,40,41。このゼラチン誘導体を使用して、生細胞の存在下でも2PPの使用に成功した例が報告されています13。構造物を作製する際にレーザーに直接暴露した細胞は死亡したものの、2PPを使用して3Dマイクロ構造の内部に細胞を封入することができました(図4B)13。さらに、この細胞傷害性は時空間的なレーザー照射や光開始剤によるものではなく、光開始剤の活性化の副生成物として細胞傷害性の物質が細胞内に生成するためである可能性が示されました13。この仮説はその後、ヒアルロン酸系の高分子光開始剤を使用して証明され、暴露した領域の中でも生細胞をカプセル化しながら2PP成形を行うことができるようになりました(図4C)42。この研究では、細胞膜を介して浸透した低分子量の光開始剤が照射の際に細胞内で光酸化傷害をもたらすことが、以前に観測された細胞傷害性の原因であることが示されました。光開始剤を高分子に固定することで、細胞の障壁の透過を防ぎ、生細胞の存在下でも2PPが可能になりました42。
このように成功している方法もありますが、2PP成形においてゼラチン-メタクリルアミドにはいくつかの制限があります。一般に、この材料を架橋するには、反応速度が遅く、機械的性質が不十分なため、比較的高いゼラチン濃度(>15 wt%)と照射量(例:スキャン速度7 mm/sで330 mW)が必要です13,14,40,43。最も重要な点として、2PPで作製した構造が作製後に膨潤することで、この方法がもたらした高分解能が失われてしまう場合があります。
他の方法として、間接的な付加製造法(以下に議論します)、または最初に疎水性アクリル酸エステルの混合物のような強度の高い材料を支持体として構築した後にゼラチンの架橋を行う手法41のような、機械的特性を向上させる支持体として機能する二次材料35,43を適用することもできます。また、PEGDAなどの二次材料を使用してコネットワークを形成することで、PEGの優れた機械的性質と、アクリル酸エステルの優れた反応速度の双方を利点が得られます35。
私たちはこれらの限界を克服するため、すべての第一級アミンがメタクリルアミドに変換され(0.385 mmol/g ゼラチン)、カルボン酸基にさらに(メタ)アクリル酸エステルが導入されたゼラチン誘導体を開発しました。このゼラチン誘導体では、ゼラチン1グラムあたり1 mmolの架橋性官能基が導入されています(図1C)5。その結果、高密度のゼラチンネットワークが形成され、高い剛性を示すと同時に作製後の膨潤もほとんどないしは全くありませんでした。また、従来のゼラチン-メタクリルアミドと比較して反応速度も向上しており、2PPの時空間的な成形の範囲が拡大しました(図1A)5。さらに、2D実験では、線維芽細胞(L929)と骨芽細胞(MC3T3)の双方との生体適合性について、Gel-MOD-AEMAと良く確立されているGel-MODが同程度であることが示されています5。
これらの官能基の追加により2PP成形は大幅に改善されますが、架橋反応には依然として既に述べたような連鎖重合型ハイドロゲルの欠点が残ります。材料成形の範囲をさらに拡大するため、チオール-エン・フォトクリックハイドロゲルを使用した2PP実験が検討されています22,23。チオール-エン・ハイドロゲル系のより優れた反応性を最大限に利用するため、タイプBゼラチンにノルボルネン基を導入しました。次に、DTTをチオール架橋剤として使用してGel-NBの2PP成形を行うと、それ以前に報告されていたすべてのゼラチン誘導体と比較して2PP成形の時空間的な範囲が劇的に向上しました。架橋性官能基の濃度が4倍低い(Gel-NB:0.24 mmol/g vs Gel-MOD-AEMA:1 mmol/g)にもかかわらず、再現可能な架橋を得るために必要なエネルギーは半減しました(Gel-NB DS 63:100 mm/sで20 mW vs Gel-MOD-AEMA:100 mm/sで40 mW)。また、レーザー出力を40 mWより大きくしても、ハイドロゲルの膨潤挙動に影響はなく、すでに材料が完全に架橋されていることが示されました。これは、Gel-MOD-AEMAでレーザー出力を大きくすると膨潤比が減少したのとは対照的な結果です5,22。さらに、再現性のある構造形成が10 w/v%未満(すなわち5 w/v%)のゼラチン濃度で初めて報告され、2PP成形に使用できる濃度範囲を拡大することができました22。注目すべき点として、ノルボルネン基は疎水性であるため、Gel-NBの膨潤比はGel-MODより大幅に低下します22。その結果、Gel-NBではコンピュータ支援設計/コンピュータ支援製造(CAD/CAM)をより模倣性できるようになると同時に、完全な変換のために必要な時空間的エネルギーが低いため、低出力のレーザーで剛性が高いゼラチン誘導体が得られます。そのため、支持構造が少ししかなくても自重を支持できる複雑な構造の作製にGel-NBを使用することができます(図4DおよびE)。さらに、この材料を使用してマイクロ足場を作製し、7日間の培養後に線維芽細胞をこの中に完全に生育させることができました(図4D)22。
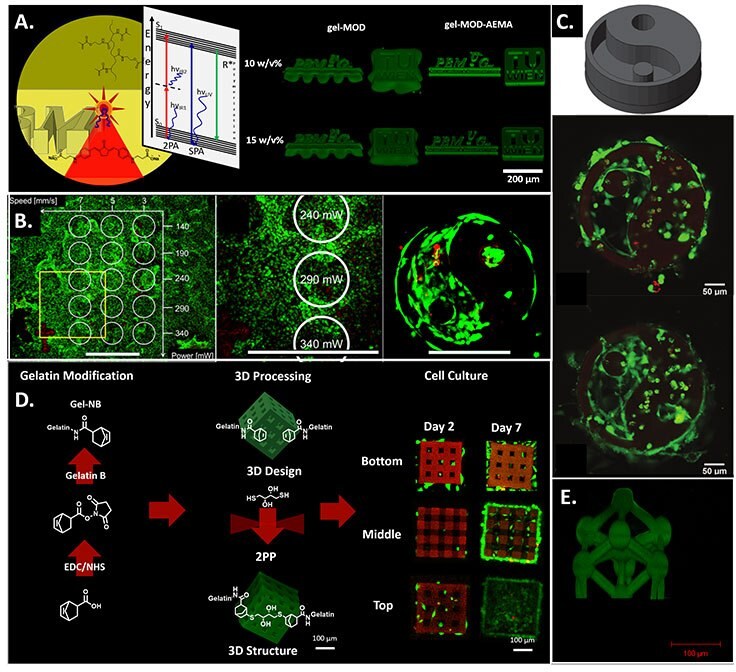
図4A)ヤブロンスキー図を含む2光子重合と1光子重合の原理の比較;作製後の膨潤によるGel-MODとGel-MOD-AEMAの形状忠実度の差異。許可を得て文献5より改編し転載。copyright 2017 ACS。B)異なるレーザー出力およびスキャン速度の細胞生存性に対する影響(左および中央のパネル、スケールバーは1 mm)。3週間の培養後のカプセル化されたMG 63細胞と3D構造(右パネル、スケールバーは200 µm)。許可を得て文献13より改編し転載。copyright 2014 ACS。C)高分子光開始剤を使用してMC3T3細胞の存在下でGel-MODの内部に作製した構造のCAD画像(上)。MC3T3細胞の存在下で高分子2光子光開始剤を使用してGel-MODの内部に作製した構造の共焦点顕微鏡画像(中央および下のパネル)。文献42より許可を得て転載。copyright 2017 Royal Society of Chemistry。D)ゼラチンのGel-NBへの修飾、チオール-エン・フォトクリック反応後の2PPによるマイクロ足場の構築、L929線維芽細胞の存在下で2日間および7日間培養した後の細胞培養物を示した概略図。文献22より許可を得て転載。copyright 2018 Wiley。E)等モルのチオール/エンの割合の10 w/v%のGel-NB - DTT溶液中で2PPにより作製されたアトミウム状のマイクロ構造。画像はMSc. J. Van Hoorick氏のご厚意によります。
結論
過去20年間を通して、組織工学の用途に適した多数の光架橋性ゼラチンが登場しています。バイオファブリケーション法の成功と、望ましい生体適合性、細胞相互作用性、優れたコスト効率が組み合わさった結果、複数の光架橋性ゼラチン誘導体が商品化されています。また、最近のチオール-エンを使用した系の成功を受けて、これら誘導体の商品化も近いと予想されています。さらに、既製の材料が利用可能であることと、コストの低下、および改良されてきた付加製造法が相まって、ハイエンドのバイオファブリケーションの飛躍的な進歩と、それに続く臨床への応用が実現するものとみられます。ゼラチンは、食品産業や医薬品産業の幅広い用途ですでにFDAの承認を受けている材料であるため、光架橋性ゼラチンを使用するバイオファブリケーション法が臨床で一般的になるのも時間の問題に過ぎません。
Acknowledgement
Jasper Van Hoorick was granted an FWO-SB PhD grant provided by the Research Foundation Flanders (FWO, Belgium).The FWOFWF grant (a bilateral Research Foundation Flanders — Austrian Science Fund project) is acknowledged for financial support.
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?