オルガノイドは、幹細胞に由来する複雑な自己組織化3D細胞培養モデルです1。一般的にオルガノイドは、脳2、腸3、胃4、結腸5、肝6 、膵臓6、肺7、腎臓8 および患者由来の腫瘍9を含む多様な組織から生成されています。腸様器官またはミニ腸と呼ばれる上皮性腸オルガノイドは、消化器系の生理学的特性を維持しており、結腸癌、セリアック病、炎症性腸疾患および宿主微生物叢相互作用の研究において、腸の発生と疾患のモデルとなる細胞培養ツールとして活用されてきました10 。Cleversらが開発した従来の分離技術1では、マウスまたは入手困難なヒトの組織サンプルから、多くの工程を経て初代組織を分離する必要があります。人工多能性幹細胞由来のオルガノイドにより、多様なヒトドナーから患者固有の細胞モデルを迅速に生成することが可能になります。私たちはヒトiPS細胞由来腸オルガノイドシステムを開発し、それにより、優れた特性を有し、すぐにアッセイ可能な凍結保存状態のヒト腸オルガノイドと成長培地を提供しています。また、私たちの最適化された無血清培地および試薬を使用することで、シンプルな3段階の分化プロセスにより、どのようなヒトiPS細胞株からも腸オルガノイドを分化させることができます。
オルガノイド培養プロトコル
ステップ1ヒトiPS細胞から胚体内胚葉への分化(0~4日目)
注記:70~80%コンフルエントであり、分化細胞が5%未満の、高品質の未分化ヒトES/iPS細胞(SCC271)から開始します。次のプロトコルは、6ウェル型組織培養処理プレートの1つのウェルを用いた分化について示したものです。1ウェル分の液量を示しています。必要に応じて、液量を調整してください。
- 単一細胞の継代培地を調製します。7~10 mLのヒトES/iPS用培地(SCM130)に、ROCK阻害剤(ROCKi)Y-27632(SCM075)を最終濃度10 µMになるよう加えます。
- ECMゲル(CC131-5ML)で6ウェルプレートをコーティングします。
- 培地を吸引します。2 mLのDMEM/F12または1X PBSでウェルを洗浄します。1 mLのAccumax™(A7089)をウェルに加え、吸引します。37℃で5~6分間インキュベートします。プレートを手のひらにしっかりと当ててたたき、細胞を剥離します。
- (ステップ1の)培地1 mLをウェルに添加します。5 mLのピペッターで1~3回上下にピペッティングし、細胞を剥離します。気泡が入らないように注意してください。
- 15 mLのコニカルチューブに剥離した細胞を回収します。培地1 mLをウェルに加え、残っている細胞を15 mLコニカルチューブに移し、細胞懸濁液の状態にします。チューブを140 x gで5分間遠心し、上清を吸引します。
- 1 mLの培地中で細胞ペレットを再懸濁します。 トリパンブルー(T8154)と血球計を使用して、生細胞の総数を数えます。
- ECM Gel(CC131-5ML)でコーティングされた6ウェルプレートに、1ウェルあたり1x106個の細胞を添加します。ステップ1の培地を必ず使用し、総量が1ウェルあたり3 mLになるようにしてください。37℃で一晩インキュベートします。
- ウェルから培地を吸引します。2 mLの胚体内胚葉誘導培地(SCM302)をウェルに加え、37℃で一晩インキュベートします。
- 2日目と3日目にステップ8を繰り返します。4日目にフローサイトメトリーで細胞を分析します。ステップ2に進む前に、内胚葉マーカーCXCR4、c-Kit、Sox-17およびFOXA2に対して85%以上の細胞が陽性、PDGFRに対して陰性でなければなりません。
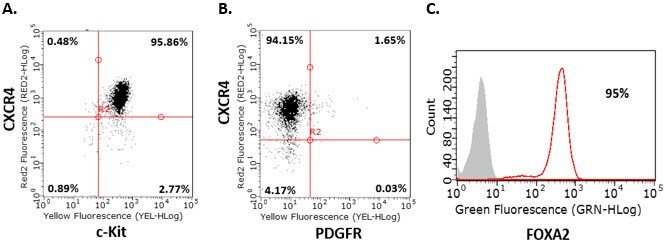
図2.ヒトiPS細胞の内胚葉分化ヒトiPS細胞由来胚体内胚葉細胞の内胚葉マーカーフローサイトメトリー分析は、分化4日後に細胞がCXCR4+、c-Kit+、Sox-17+、PDGFR- およびFOXA2+であることを示しています。
ステップ2:後腸内胚葉分化(4~8日目)
- インキュベーターから4日目の胚体内胚葉培養液が入っている6ウェルプレートを取り出します。
- 各ウェルから培地を吸引します。
- 各ウェルを3 mL 1X PBSで洗浄します。
- 事前に温めた後腸誘導培地(SCM303)2 mLを各ウェルに加えます。
- 直ちにプレートを5% CO2の37℃インキュベーターに移し、24時間静置します。
- 合計5日間、ステップ2~5を繰り返します。
- 後腸内胚葉(HE)分化の5日目が、CDX2の発現を決定する重要な時点です。 ステップ3に進むには、CDX2の発現が60%超でなければなりません。CDX2の発現が60%未満の場合、HE分化をさらに1日続けて、CDX2の発現を再確認します。

図3.胚体内胚葉細胞の後腸内胚葉細胞への分化後腸内胚葉誘導後A)2日目、B)3日目およびC)4日目における後腸内胚葉細胞の形態
ステップ3腸オルガノイドの培養と凍結保存(8~48日目)
腸オルガノイドの培養
- 培養8日目の後腸内胚葉を含む6ウェルプレートをインキュベーターから取り出します。
- 各ウェルから培地を吸引します。
- 3 mLの1x PBSで各ウェルを洗浄します。
- 事前に温めた3dGRO™ヒト腸オルガノイド培地(SCM304)2 mLを各ウェルに加えます。
- 直ちにプレートを5% CO2のインキュベーターに移し、37℃で48時間静置します。
- 分化12日目まで、3dGRO™ヒト腸オルガノイド培地(SCM304)を2日ごとに培地交換します。
注記:腸スフェロイドは12日目の終わりに形成され、3dGRO™ヒト腸オルガノイド培地(SCM304)を使用することでマトリゲル®マトリックスに包まれた状態で成熟した腸オルガノイドが形成されます。
- ROCK阻害剤 Y-27632(SCM075)を10 µMの濃度になるように、ヒト腸オルガノイド培地(SCM304)に添加します。
- 十分な量のGrowth Factor Reduced マトリゲルを4℃で一晩、または氷上で解凍します。
- 分化12日目の腸上皮細胞をインキュベーターから取り出し、培地に浮遊しているスフェロイドを15 mLコニカルチューブに収集します。
- 各ウェルを3 mL 1x PBSで洗浄します。
- 1 mLのAccumax(A7089)でスフェロイド(非浮遊スフェロイド)を含む単層を分離し、37℃で5~10分間インキュベートします。
- 単層が緩んだら、P-1000ピペットで細胞を4~5回静かにピペッティングし、1 mLの細胞懸濁液を上記のステップ9で準備したコニカルチューブに移します。
- 4℃で265 x gで5分間遠心します。
- 上清を吸引し、4 mLの1x PBSで1回洗浄します。
- 4℃で265 x g、5分間遠心し、上清を吸引します。
- コニカルチューブの底をそっとはじいて、ペレットを剥離します。
- TCフード内にマトリゲル®マトリックスを入れ、速やかに1 mLを取り除き、それをステップ16で剥離した細胞ペレットに添加します。
- マトリゲル® マトリックス中の細胞ペレットを、900 µLに設定したP-1000ピペットで穏やかに再懸濁します。再懸濁中に気泡を入れないようにしてください。
- ゲル化を防ぐため、直ちに細胞懸濁液を氷上に5分間置きます。
- 新鮮なマトリゲル®マトリックス中で、1 mL マトリゲル®<308>マトリックス/細胞懸濁を希釈(1:50から1:100)し、24ウェルプレートの各ウェルに50 µL/ドームを添加します(例:1:100希釈の場合、ステップ18のマトリックス/細胞10 µLと新鮮なマトリックス40 µLを合わせ、50 µL/ウェルを添加します)。以下の図4を参照してください。
- 直ちに24ウェルプレートを37℃で10分間インキュベートします。
- ドームがゲル化したら、1 mLの3dGRO™ヒト腸オルガノイド培地(SCM304)+ 10 µM ROCK阻害剤(SCM075)を加えます。
- 1 mLの新鮮な 3dGRO™ヒト腸オルガノイド培地(SCM304)を使用して、2日ごとに培地を交換します。
- オルガノイドは、1:3~1:4の比で3dGRO™オルガノイド分離試薬(SCM300)を使用して10~12日ごとに継代できます。

図4.ヒト腸オルガノイドA)マトリゲル®マトリックスドーム中にカプセル化された結腸オルガノイド、解凍2日後。B)培養10~12日目までに、腸オルガノイドはドームの85~90%を占め、継代が可能となります。
腸オルガノイドの凍結保存
3dGRO™オルガノイド凍結培地(SCM301)を使用して、ヒト腸オルガノイドを凍結保存できます。このプロトコルでは、凍結保存するヒト腸オルガノイドの継代中に分散用試薬を使用しません。各ドームの密度が90%であると仮定して、作業開始時のバイアルあたりのドーム数は4を推奨しています。密度が90%未満の場合、バイアルごとにより多くのドームを凍結します。
- オルガノイドが凍結保存のための継代ができる状態であれば、インキュベーターからプレートを取り出します。
- P-1000ピペットで上下に5回ピペッティングして、既存の1 mLの培地に各マトリゲルマトリックスドームを再懸濁します。
- オルガノイド懸濁液をコニカルチューブに移します。
- コニカルチューブの壁の側面に沿って10 mLピペットで10回ピペッティングすることにより、オルガノイドの分散操作を続けます。
- コニカルチューブを265~700 x gで遠心分離します。
- 上清を吸引し、1 mLの1x PBSでペレットを再懸濁します。
- P-1000ピペットで20回上下にピペッティングすることにより、オルガノイドペレットの分散操作を続けます。
- オルガノイド懸濁液に5 mLの1x PBSを加え、4℃で700 x g、5分間遠心します。上清にオルガノイド断片が残っている場合は、さらに5分間遠心します。
- 上清を吸引し、1 mLの3dGRO™オルガノイド凍結培地(SCM301)でペレットを再懸濁します。
- P-1000ピペットでペレットを5回再懸濁し、バイアルごとに1 mL中4つのドームとなるように残りの凍結培地を追加します。
- 凍結保存バイアル内の細胞を凍結容器(Mr. Frostyなど)に移し、24~72時間、-80℃の冷凍庫に入れます。
- 凍結保存されたヒト腸オルガノイドを液体窒素タンクに移し、長期保存します。
結果

図5.ヒトiPS細胞由来腸オルガノイドの形態成熟したヒト腸オルガノイドは、3次元で培養すると複雑な形態を呈します。A)4x倍率、B)10x倍率。
Human Colon Organoid Characterization |
|---|
CDX2
CA-IV/DAPI
Mucin-5B/DAPI
Mucin-2/F-Actin/DAPI

CDX2

CA-II/DAPI

CA-IV/DAPI

Mucin-5B/DAPI

Mucin-2/F-Actin/DAPI

E-Cad/DAPI
図6.ヒト腸オルガノイドの免疫細胞化学(ICC)特性評価ヒトiPS細胞由来の結腸オルガノイドは、CDX2、α-炭酸脱水酵素-II、α-炭酸脱水酵素-IV、Mucin-5B、Mucin-2およびE-カドヘリンに対して陽性を示します。

図7.ヒト腸オルガノイドの免疫組織化学(IHC)特性評価A)アルシアンブルー染色で同定された杯細胞、B)Ki67抗体を使用して同定された増殖細胞(赤)、C)H&E染色を使用して同定された核および細胞質タンパク質。
結論
私たちは、ヒト誘導多能性幹細胞(iPS細胞)からヒト腸オルガノイドを生成するための3段階分化プロトコルを開発しました。このプロトコルを使用して生成された腸オルガノイドは、成熟腸マーカーCDX2、α-炭酸脱水酵素-II、α-炭酸脱水酵素-IV、Mucin 5B、Mucin 2およびE-カドヘリンを発現し、腸の表現型を失うことなく複数回連続的に継代できます。これらのオルガノイドと無血清培地により、研究者は創薬で腸疾患を研究するための高度に実証された新しい3D細胞モデルを利用することができます。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?