おすすめの製品
由来生物
bovine erythrocytes
製品種目
BioUltra
アッセイ
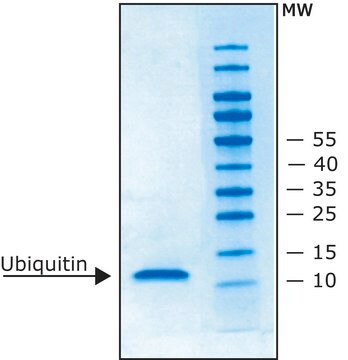
≥98% (SDS-PAGE)
形状
essentially salt-free, lyophilized powder
保管条件
(Tightly closed. Dry)
テクニック
western blot: suitable
不純物
salt, essentially free
溶解性
water: 1 mg/mL, clear, colorless
UniProtアクセッション番号
保管温度
2-8°C
遺伝子情報
bovine ... LOC(101902760)
類似した製品をお探しですか? 訪問 製品比較ガイド
関連するカテゴリー
詳細
研究分野:がん
ユビキチンは、高度に保存された制御タンパク質です。すべての真核細胞に存在しており、酵母、ヒト、植物を含めたあらゆる種類の生物で実質的に同一です。ユビキチン構造には、7つのLys残基とN-末端が含まれており、これらはすべてユビキチン化の標的部位です。
ユビキチンは、高度に保存された制御タンパク質です。すべての真核細胞に存在しており、酵母、ヒト、植物を含めたあらゆる種類の生物で実質的に同一です。ユビキチン構造には、7つのLys残基とN-末端が含まれており、これらはすべてユビキチン化の標的部位です。
アプリケーション
ウシ赤血球由来ユビキチンは、慢性的 β-アドレナリン受容体(β-AR)刺激による心筋リモデリングにおける外来性ユビキチンの役割を調べるために使用されています。また、核内因子カッパ-Bキナーゼサブユニットベータ(IKKβ)のユビキチン化の阻害薬を調べるためにも使用されています。
ウシ赤血球由来ユビキチンは、in vitro ユビキチン化アッセイで使用できます。本製品はウエスタンブロット法においてマーカーとして使用することもできます。
ウシ赤血球由来ユビキチンは、in vitro ユビキチン化アッセイで使用できます。本製品はウエスタンブロット法においてマーカーとして使用することもできます。
生物化学的/生理学的作用
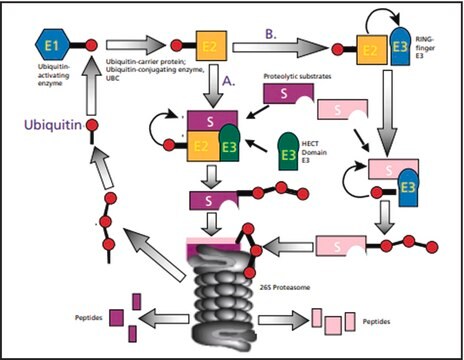
ユビキチン化は、ユビキチンタンパク質が基質タンパク質に結合する翻訳後修飾プロセスです。ユビキチン化は、アポトーシス、タンパク質プロセシング、免疫応答、DNA修復などさまざまな生物学的プロセスにおける細胞シグナル伝達の制御において非常に重要な役割を果たしています。ユビキチン化は、ユビキチン-プロテアソーム経路を介してタンパク質分解を媒介しています。ユビキチン化は、さまざまな細胞シグナル伝達経路に関与しています。ポリユビキチン化は、炎症シグナル伝達経路におけるNF-κ-B阻害剤アルファ(IkB-α)のシグナル活性化を調節しています。ユビキチンレベルの上昇は、寄生虫症、アレルギー疾患、アルコール性肝疾患、2型糖尿病、β2-ミクログロブリンアミロイドーシス、慢性血液透析などさまざまな疾患で観察されています。
調製ノート
ウシの赤血球由来のユビキチンは1 mg/mLで水に溶解し、無色透明の溶液が得られます。
抗体
製品番号
詳細
価格
保管分類コード
11 - Combustible Solids
WGK
WGK 3
引火点(°F)
Not applicable
引火点(℃)
Not applicable
個人用保護具 (PPE)
Eyeshields, Gloves, type N95 (US)
適用法令
試験研究用途を考慮した関連法令を主に挙げております。化学物質以外については、一部の情報のみ提供しています。 製品を安全かつ合法的に使用することは、使用者の義務です。最新情報により修正される場合があります。WEBの反映には時間を要することがあるため、適宜SDSをご参照ください。
Jan Code
U6253-BULK:
U6253-5MG:
U6253-VAR:
U6253-424UG-KC:
U6253-25MG:
試験成績書(COA)
製品のロット番号・バッチ番号を入力して、試験成績書(COA) を検索できます。ロット番号・バッチ番号は、製品ラベルに「Lot」または「Batch」に続いて記載されています。
この製品を見ている人はこちらもチェック
A L Schwartz et al.
Annual review of medicine, 50, 57-74 (1999-03-12)
The ubiquitin-proteasome pathway plays a pivotal role in the degradation of short-lived and regulatory proteins important in a variety of basic cellular processes, including regulation of the cell cycle, modulation of cell surface receptors and ion channels, and antigen presentation.
Frederik Lermyte et al.
The Analyst, 142(18), 3388-3399 (2017-08-16)
Electron transfer dissociation (ETD) is becoming increasingly important in mass spectrometry-based analysis of peptides and proteins. Supplemental collisional activation of undissociated electron transfer products can significantly increase fragmentation yield and sequence coverage, but hydrogen rearrangements - specifically, transfer of a
Frederik Lermyte et al.
Journal of the American Society for Mass Spectrometry, 28(1), 69-76 (2016-08-09)
Owing to its versatility, electron transfer dissociation (ETD) has become one of the most commonly utilized fragmentation techniques in both native and non-native top-down mass spectrometry. However, several competing reactions-primarily different forms of charge reduction-occur under ETD conditions, as evidenced
The ubiquitin system for protein degradation.
A Hershko et al.
Annual review of biochemistry, 61, 761-807 (1992-01-01)
Errol W Robinson et al.
Analytical chemistry, 80(19), 7508-7515 (2008-08-30)
Field asymmetric waveform ion mobility spectrometry (FAIMS) has emerged as an analytical tool of broad utility, especially in conjunction with mass spectrometry. Of particular promise is the use of FAIMS and 2-D ion mobility methods that combine FAIMS with conventional
ライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)