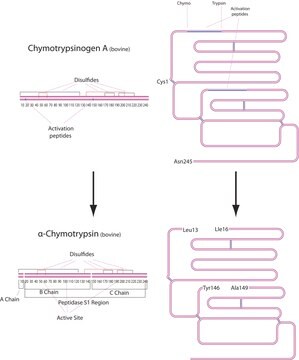
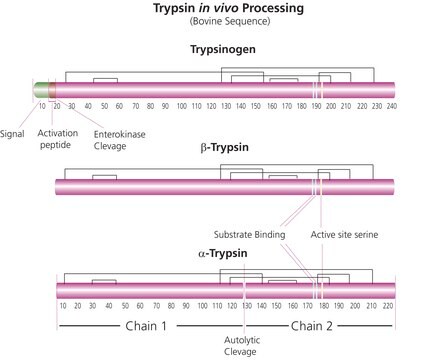
おすすめの製品
アプリケーション
ペプチドをトリプシンで消化する場合、トリプシン:ペプチドについて約 1:100~1:20 の比を使用してください。この製品の代表的な用途は、培養表面から接着細胞を除去することです。細胞をその基材から除去するのに必要なトリプシンの濃度は、主に細胞型および培養の時期に依存します。トリプシンはまた、細胞培養期間中に細胞を再懸濁するために、タンパク質の消化に関するプロテオミクス研究において、およびさまざまなインゲル消化において使用されています†。さらなる応用例として、膜ベースの技術により結晶化を評価すること、ならびにタンパク質のフォールディング速度および収率は動的トラップの存在により制限を受ける可能性があることを試験において明確にすることが挙げられます。
生物化学的/生理学的作用
トリプシンは、リシンおよびアルギニン残基の C 末端側でペプチドを開裂させます。この反応の加水分解速度は、酸性残基が切断部位のいずれかの側にある場合に低速化し、また加水分解は、プロリン残基が切断部位のカルボキシル側にある場合には停止します。トリプシン活性の至適 pH は 7~9 です。トリプシンは、アミノ酸の合成誘導体のエステル結合およびアミド結合を開裂させるように作用することも可能です。トリプシンが作用するペプチド結合を覆い隠すカルシウムおよびマグネシウムイオンを中和するキレート剤として、EDTA がトリプシン溶液に添加されます。これらのイオンを除去すると酵素活性が上昇します。
DFP、TLCK、APMSF、AEBSEF、およびアプロチニン等を含むセリンプロテアーゼ阻害剤がトリプシンを阻害します。
DFP、TLCK、APMSF、AEBSEF、およびアプロチニン等を含むセリンプロテアーゼ阻害剤がトリプシンを阻害します。
単位の定義
1 Uは、N-ベンゾイル-L-アルギニンエチルエステル(製品番号12880)を基質として、pH 7.6、25°C、1分間で、波長253 nmの光に対する吸光度を0.001増大させる酵素量に相当します。
1BAEE ユニットは、BAEE を基質として用いた場合、25°C、pH 7.6 で 1 分当たり 0.001 のΔA253 を生成します。1BTEE ユニット = 320ATEE ユニット。反応容積 = 3.2 mL(光路長 1 cm)。
その他情報
販売に制約がある場合があります。
シグナルワード
Danger
危険有害性情報
危険有害性の分類
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
ターゲットの組織
Respiratory system
保管分類コード
11 - Combustible Solids
WGK
WGK 1
個人用保護具 (PPE)
dust mask type N95 (US), Eyeshields, Faceshields, Gloves
適用法令
試験研究用途を考慮した関連法令を主に挙げております。化学物質以外については、一部の情報のみ提供しています。 製品を安全かつ合法的に使用することは、使用者の義務です。最新情報により修正される場合があります。WEBの反映には時間を要することがあるため、適宜SDSをご参照ください。
労働安全衛生法名称等を表示すべき危険物及び有害物
名称等を表示すべき危険物及び有害物
労働安全衛生法名称等を通知すべき危険物及び有害物
名称等を通知すべき危険物及び有害物
Jan Code
93615-5G:
93615-VAR:
93615-25G:
93615-BULK:
93615-1G:
この製品を見ている人はこちらもチェック
Peter Halasz et al.
Journal of virology, 82(1), 148-160 (2007-10-19)
Changes in the interactions between intestinal cells and their surrounding environment during virus infection have not been well documented. The growth and survival of intestinal epithelial cells, the main targets of rotavirus infection, are largely dependent on the interaction of
Olivier Rivoire
Physical review letters, 110(17), 178102-178102 (2013-05-18)
Studies of coevolution of amino acids within and between proteins have revealed two types of coevolving units: coevolving contacts, which are pairs of amino acids distant along the sequence but in contact in the three-dimensional structure, and sectors, which are
Mian Zhou et al.
Nature, 495(7439), 111-115 (2013-02-19)
Codon-usage bias has been observed in almost all genomes and is thought to result from selection for efficient and accurate translation of highly expressed genes. Codon usage is also implicated in the control of transcription, splicing and RNA structure. Many
Janina Boyken et al.
Neuron, 78(2), 285-297 (2013-04-30)
Neurotransmission involves calcium-triggered fusion of docked synaptic vesicles at specialized presynaptic release sites. While many of the participating proteins have been identified, the molecular composition of these sites has not been characterized comprehensively. Here, we report a procedure to biochemically
Paul P Geurink et al.
Journal of medicinal chemistry, 56(3), 1262-1275 (2013-01-17)
Proteasomes degrade the majority of proteins in mammalian cells by a concerted action of three distinct pairs of active sites. The chymotrypsin-like sites are targets of antimyeloma agents bortezomib and carfilzomib. Inhibitors of the trypsin-like site sensitize multiple myeloma cells
ライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)