About This Item
Produtos recomendados
Formulário
powder
atividade específica
~1500 U/mg
peso molecular
23.8 kDa
atividade externa
chymotrypsin ≤0.1%
temperatura de armazenamento
2-8°C
Procurando produtos similares? Visita Guia de comparação de produtos
Categorias relacionadas
Aplicação
Para digestão de peptídeos por tripsina, use uma proporção de cerca de 1:100 a 1:20 de tripsina:peptídeo. O uso típico deste produto é na remoção de células aderentes da superfície de uma cultura. A concentração de tripsina necessária para deslocar as células do seu substrato depende principalmente do tipo de célula e da idade da cultura. As tripsinas também foram usadas para ressuspender células durante a cultura celular, para pesquisa em proteômica para digerir proteínas e em diversas digestões em gel†. Outras aplicações incluem a avaliação da cristalização por técnicas baseadas em membranas e em um estudo para determinar que as taxas de dobramento de proteínas e a produção de proteínas podem ser limitadas pela presença de armadilhas cinéticas.
Ações bioquímicas/fisiológicas
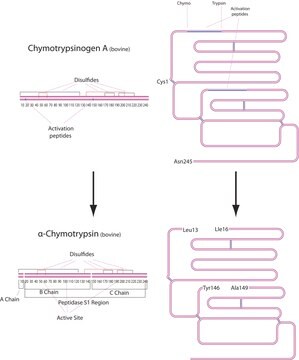
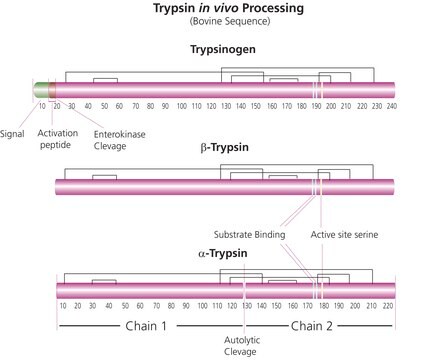
A tripsina cliva peptídeos no lado C-terminal dos resíduos de lisina e arginina. A velocidade da hidrólise dessa reação é retardada se houver um resíduo ácido em qualquer um dos lados do sítio de clivagem e a hidrólise é interrompida se houver um resíduo de prolina no lado carboxílico do sítio de clivagem. O pH ideal para atividade da tripsina é 7-9. A tripsina pode agir também para clivar ligações de ésteres e amidas em derivados sintéticos de aminoácidos. O EDTA é adicionado às soluções de tripsina como agente quelante que neutraliza os íons de cálcio e magnésio que obstruem as ligações peptídicas nas quais a tripsina age. A remoção desses íons aumenta a atividade enzimática.
Os inibidores de protease de serina, inclusive o DFP, TLCK, APMSF, AEBSEF e a aprotinina, dentre outros, inibem a tripsina.
Os inibidores de protease de serina, inclusive o DFP, TLCK, APMSF, AEBSEF e a aprotinina, dentre outros, inibem a tripsina.
Definição da unidade
Uma unidade de BAEE produz um ΔA253 de 0,001 por minuto em pH 7,6 a 25 °C usando BAEE como substrato. Uma unidade de BTEE = 320 unidades de ATEE. Volume de reação = 3,2 ml (caminho óptico de 1 cm).
1 U corresponds to the amount of enzyme which increases the absorbance at 253 nm by 0.001 per minute at pH 7.6 and 25°C (N-benzoyl-L-arginine ethyl ester, Cat. No. 12880, as substrate)
Outras notas
Sales restrictions may apply
Palavra indicadora
Danger
Frases de perigo
Declarações de precaução
Classificações de perigo
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
Órgãos-alvo
Respiratory system
Código de classe de armazenamento
11 - Combustible Solids
Classe de risco de água (WGK)
WGK 1
Equipamento de proteção individual
dust mask type N95 (US), Eyeshields, Faceshields, Gloves
Escolha uma das versões mais recentes:
Já possui este produto?
Encontre a documentação dos produtos que você adquiriu recentemente na biblioteca de documentos.
Os clientes também visualizaram
Peter Halasz et al.
Journal of virology, 82(1), 148-160 (2007-10-19)
Changes in the interactions between intestinal cells and their surrounding environment during virus infection have not been well documented. The growth and survival of intestinal epithelial cells, the main targets of rotavirus infection, are largely dependent on the interaction of
Olivier Rivoire
Physical review letters, 110(17), 178102-178102 (2013-05-18)
Studies of coevolution of amino acids within and between proteins have revealed two types of coevolving units: coevolving contacts, which are pairs of amino acids distant along the sequence but in contact in the three-dimensional structure, and sectors, which are
Mian Zhou et al.
Nature, 495(7439), 111-115 (2013-02-19)
Codon-usage bias has been observed in almost all genomes and is thought to result from selection for efficient and accurate translation of highly expressed genes. Codon usage is also implicated in the control of transcription, splicing and RNA structure. Many
Janina Boyken et al.
Neuron, 78(2), 285-297 (2013-04-30)
Neurotransmission involves calcium-triggered fusion of docked synaptic vesicles at specialized presynaptic release sites. While many of the participating proteins have been identified, the molecular composition of these sites has not been characterized comprehensively. Here, we report a procedure to biochemically
Paul P Geurink et al.
Journal of medicinal chemistry, 56(3), 1262-1275 (2013-01-17)
Proteasomes degrade the majority of proteins in mammalian cells by a concerted action of three distinct pairs of active sites. The chymotrypsin-like sites are targets of antimyeloma agents bortezomib and carfilzomib. Inhibitors of the trypsin-like site sensitize multiple myeloma cells
Nossa equipe de cientistas tem experiência em todas as áreas de pesquisa, incluindo Life Sciences, ciência de materiais, síntese química, cromatografia, química analítica e muitas outras.
Entre em contato com a assistência técnica