Fullereny do zastosowań w biologii i fotowoltaice
Michael D. Diener
TDA Research
Fullereny skondensowane
Fullereny w fotowoltaice
Fullereny w naukach biologicznych
Fullereny o małej pojemności
Wprowadzenie
Dwadzieścia pięć lat temu odkryto, że opary węgla preferencyjnie kondensują się w niezwykle stabilny klaster z 60 atomami węgla (C60) i postawiono hipotezę, że 60 atomów jest ułożonych jak wierzchołki ściętego dwudziestościanu, czyli piłki nożnej.1 Klaster węglowy został nazwany Buckminsterfullerene, na cześć architekta konstrukcji budowlanych opartych na kopułach geodezyjnych. Pięć lat później, stosując metody syntezy Buckminsterfullerenu w miligramowych ilościach, ujawniono, że klastry C60 są nie tylko stabilne w powietrzu, ale także rozpuszczalne w rozpuszczalnikach aromatycznych.2 Teraz słusznie uważane za cząsteczki zamiast metastabilnych klastrów, stało się jasne, że C60 nie był jedynym "fullerenem", ale istnieje cały zestaw stabilnych, rozpuszczalnych, całkowicie węglowych cząsteczek z C70 (Nr produktu. 482994), C76 (Product No. 482951), C78 (Product No. 482978), C84 (Product No. 482986), a nawet ponad 100 atomów na cząsteczkę (bez atomów wodoru). W naturze fulereny zostały wykryte w pyłach międzygwiezdnych i w ziemi w pobliżu uderzeń meteorytów. Z biegiem czasu ich synteza z oparów węgla postępowała od gramów do kilogramów, a ostatecznie technika ich syntezy w płomieniach sadzy doprowadziła do ich produkcji w tonach.3 Tak więc to, co prof. Eiji Osawa opisał kiedyś jako problem kury i jajka - nie ma komercyjnych zastosowań fulerenów, ponieważ nie ma produkcji na dużą skalę, a nie ma produkcji na dużą skalę, ponieważ nie ma zastosowań komercyjnych - zostało rozwiązane.
Rozwój fulerenów do różnych zastosowań komercyjnych znajduje się obecnie w punkcie krytycznym. Artykuły sportowe, takie jak rakiety do badmintona z fulerenami w kompozycie matrycy polimerowej, oraz kosmetyki, takie jak kremy do skóry z witaminą C60, są dostępne dla konsumentów na wybranych rynkach. Materiały fulerenowe są już badane pod kątem szerokiej gamy zastosowań obecnie wypełnianych przez inne formy węgla, w tym nośniki katalizatorów, anody baterii i membrany transportujące proton. Jednak zdecydowanie najbardziej nagłośnione i najbardziej obiecujące osiągnięcia w badaniach nad fulerenami dotyczą elektroniki organicznej i nauk biologicznych.
Fullereny w fotowoltaice
Fullereny charakteryzują się niezwykle niską energią reorganizacji po przeniesieniu elektronu, co czyni je jednymi z najbardziej użytecznych cząsteczek akceptorów elektronów w elektronice organicznej.4 Są one również półprzewodnikami typu n (z przerwą pasmową = 2,3eV), co czyni je dobrym odpowiednikiem licznych dobrych półprzewodników organicznych typu p. Ich (prawie) sferyczna struktura pozwala na transfer elektronów w dowolnym kierunku przestrzennym bez preferencji, a ich ruchliwość elektronów (µe= 0.1cm2/Vs) jest doskonała dla materiału organicznego. C60 lub C70 mogą być używane do produkcji tranzystorów o doskonałej wydajności w środowiskach obojętnych. Ponadto wiele soli anionowych ("fulleridowych") C60 jest nadprzewodnikami o przyzwoitych temperaturach przejścia (~30 K).
Fullereny znalazły również zastosowanie w dynamicznie rozwijającej się dziedzinie badań nad organiczną fotowoltaiką (OPV). Poczyniono znaczne postępy w zakresie wydajności konwersji energii urządzeń, a także rozwoju bardziej stabilnych architektur plastikowych ogniw słonecznych.5 Fullereny służą jako akceptor elektronów w prawie wszystkich zgłoszonych urządzeniach o wysokiej wydajności (Rysunek 1). C60 jest standardem dla OPV osadzanych próżniowo, podczas gdy bardziej rozpuszczalny PCBM (Product No. 684449) jest standardem dla OPV osadzanych w roztworze. Dalsza poprawa wydajności jest zwykle możliwa przy użyciu PC70BM (Product No. 684465). Energie pasm fullerenów pokrywają się umiarkowanie dobrze z pasmami cząsteczek pochłaniających fotony/donorujących elektrony, co prowadzi do dość wydajnej dysocjacji ekscytonów i transferu ładunku. Przewiduje się znaczny wzrost tej szybko rozwijającej się technologii w najbliższej przyszłości.

Fullereny w naukach biologicznych
Zdolność do dodawania elektronów, a następnie ich usuwania przy niemal zerowym koszcie energetycznym, leży również u podstaw podstawowego biologicznego zastosowania fullerenów: jako przeciwutleniaczy. Niektóre rozpuszczalne w wodzie fulereny katalitycznie usuwają potencjalnie szkodliwe formy utleniaczy, działając jako syntetyczny analog naturalnie występującej dysmutazy ponadtlenkowej. Ich działanie przeciwutleniające, a być może antyproliferacyjny efekt usuwania wolnych rodników zaangażowanych w cykl komórkowy, wydłużyło żywotność myszy geriatrycznych, a także poprawiło ich funkcje poznawcze w zaawansowanym wieku.6 W rezultacie rozpuszczalne w wodzie fulereny, takie jak C60 tris-kwas pirolidyniowy (nr produktu. 709085), są badane pod kątem zastosowań w terapiach przeciwko różnym stanom zwyrodnieniowym obejmującym nadmiar reaktywnych form tlenu.
Fullereny są również opracowywane do zastosowań związanych z dostarczaniem leków. Mają one bogatą i dobrze udokumentowaną chemię organiczną, a naukowcy opracowali wiele wszechstronnych dróg tworzenia wiązań kowalencyjnych z fulerenami. Różne środki terapeutyczne zostały kowalencyjnie przyłączone do fulerenów przy użyciu tych metod, umożliwiając dostosowanie ich właściwości farmakokinetycznych.7 Podczas gdy wiele nanomateriałów jest opracowywanych w tym samym celu, kompaktowy rozmiar fulerenów (średnica ~1 nm, zilustrowana w przyp. tłum.nbsp;Rysunek 2) wypada korzystnie w porównaniu do nanocząstek (średnica 10 - 100 nm) pod względem zwiększenia rozpuszczalności i uniknięcia agregacji podczas dostarczania. Co więcej, C60 jest specyficzną, izomerycznie czystą cząsteczką, a kowalencyjnie związane pochodne można łatwo scharakteryzować za pomocą standardowych technik chemii analitycznej.
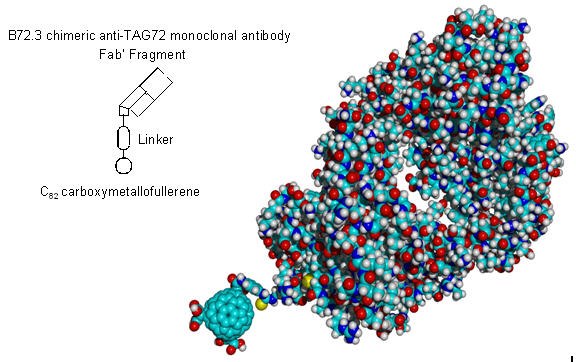
Rysunek 2.Hipotetyczny koniugat przeciwciała fulerenowego zbudowany z karboksymetallofullerenu C82 i chimerycznego fragmentu przeciwciała B72.3 Fab'. Struktura rentgenowska B72.3 pochodzi z krajowej bazy danych białek, wpis 1BBJ.1.
Wnęka w środku klatki węglowej jest kolejną nieodłączną i unikalną właściwością fulerenów. Przestrzeń ta może pomieścić atomy lub skupiska co najwyżej kilku atomów. Gdy atomy znajdą się wewnątrz fullerenu, tylko niezwykle energetyczne zdarzenia, takie jak odrzut jądrowy po rozpadzie alfa, pozwolą im uciec. W rezultacie te "endoedryczne fullereny", fullereny z jednym lub więcej atomami wewnątrz, są opracowywane jako środki do obrazowania. Obrazowanie jest nadal możliwe dzięki zamkniętemu atomowi, ale biodystrybucja jest teraz dyktowana przez fuleren i kowalencyjnie związane grupy przyłączone do jego zewnętrznej części. Środki kontrastowe do obrazowania metodą rezonansu magnetycznego (MRI) są wiodącym przykładem rozwoju fullerenowych środków obrazujących, ale badane są również fullereny transportujące izotopy radioaktywne. Szereg pochodnych fullerenów badano również jako sensybilizatory do terapii fotodynamicznej oraz agregaty do transfekcji DNA.
Chociaż wstępne doniesienia o znacznej toksyczności wodnych zawiesin C60 agregatów ("nano-C60") przyciągnęły szeroką uwagę w prasie drugorzędnej, późniejsze badania ostatecznie wykazały, że toksyczność była spowodowana produktem ubocznym metody tworzenia zawiesiny wodnej, a nie samymi fulerenami.9 Niemniej jednak, pochodne fulerenów zawierające określone grupy chemiczne mogą zakłócać ściany komórkowe i być stosowane jako środki przeciwbakteryjne i przeciwwirusowe.
Fullereny o małej szczelinie
W partnerstwie z TDA Research, mamy przyjemność przedstawić oczyszczone fulereny o małej szczelinie (nr produktu. 707503).11 Do tej pory wszystkie dostępne na rynku fulereny były odzyskiwane z niefullerenowej matrycy węglowej za pomocą ekstrakcji rozpuszczalnikowej. Proces ekstrakcji rozpuszczalnikiem jest jednak stosunkowo nieefektywny, ponieważ wiele fulerenów polimeryzuje do stanu nierozpuszczalnego. W polimeryzacji może pośredniczyć tlen, ale może ona również zachodzić spontanicznie. Fullereny z małymi różnicami energii między wypełnionymi i niewypełnionymi stanami elektronowymi poszczególnych cząsteczek fullerenu ("fullereny z małą przerwą") są szczególnie podatne na taką spontaniczną polimeryzację,12 i dlatego nie są odzyskiwane przez ekstrakcję rozpuszczalnikiem. Procent izomerów o określonym rozmiarze klatki, które są "małymi szczelinami", dramatycznie wzrasta wraz ze wzrostem rozmiaru klatki; tak więc fullereny ekstrahowane rozpuszczalnikiem mają niewiele gigantycznych fullerenów, podczas gdy fullereny o małych szczelinach (SGF) są bogate w gigantyczne fullereny większe niż C84.11 Pomimo ich względnej obfitości, SGF są zwykle odrzucane wraz z niefullerenową matrycą węglową.
Rysunek 3 porównuje rozkład fullerenów w surowej sadzy ze spalania z rozkładem fullerenów SGF, a także konwencjonalnych fullerenów ekstrahowanych rozpuszczalnikiem. Widma masowe zostały wygenerowane za pomocą spektrometrii masowej czasu przelotu (TOF-MS) przy użyciu impulsu laserowego 355 nm do desorpcji fulerenów i impulsu laserowego 118 nm do jonizacji fulerenów. Ponieważ wszystkie fulereny są jonizowane pojedynczym fotonem o długości fali 118 nm, przedstawiony rozkład jest dokładny dla fulerenów w fazie gazowej, chociaż nie wszystkie fulereny mogą być desorbowane z równą wydajnością. Analiza wysokości pików pokazuje, że 60% obecnych fullerenów jest większych niż C70, a 50% obecnych fullerenów jest większych niż C84. Pozostałe C60 i C70 wydają się być związane w polimerach i dlatego nie są ekstrahowane przez rozpuszczalniki. SGF są niezwykle bogate w rozmiary klatek fullerenowych i izomery, które nie są obecne w konwencjonalnych fullerenach ekstrahowanych rozpuszczalnikami, w tym, na przykład, C74.
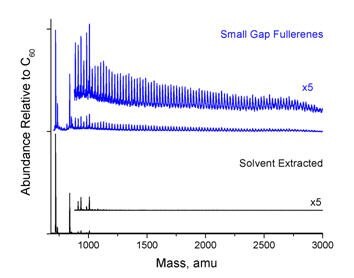
Rysunek 3.Góra: Rozkład masy produktu fullerenowego o małej szczelinie. Dół: rozkład fullerenów odzyskanych w konwencjonalnej ekstrakcji rozpuszczalnikiem.
SGF mogą znaleźć zastosowanie zarówno jako materiały fulerenowe, jak i, po kowalencyjnej modyfikacji chemicznej, jako pochodne fulerenów. Po otrzymaniu lub po obróbce termicznej w celu przekształcenia resztkowych zanieczyszczeń węglowodorowych w węgiel, SGF tworzą nowy nanostrukturalny materiał węglowy, który może być przydatny jako sorbent, nośnik katalizatora lub dodatek do matryc polimerowych. Po redukcji do odpowiedniego rozpuszczalnika, w którym aniony fulerenowe są dyskretnymi rozpuszczalnymi cząsteczkami, folie SGF mogą być nakładane galwanicznie na szereg podłoży w celu uzyskania nowych powłok węglowych (Rysunek 4). Na przykład, sprasowane granulki SGF mają przewodność objętościową ~10-4 S/cm.

Rysunek 4.Galwanizowana folia SGF na folii Ti.
Chociaż chemia SGF pozostaje w powijakach, niektóre reakcje znane dla C60 również derywatyzują SGF, prowadząc do rozpuszczalnych produktów.13 Na przykład, rozpuszczalne w wodzie polihydroksylowane SGF (Nr produktu. 707481), które mogą być użyteczne jako rozpuszczalne w wodzie przeciwutleniacze/antyproliferanty. Alternatywnie, rozpuszczalne organicznie estry SGF (nr produktu. 707473), jak pokazano na Rysunku 5 mogą być produkowane, które mogą znaleźć zastosowanie w organicznej elektronice przetwarzalnej w roztworze jako materiały typu n.
.
Rysunek 5.Po lewej: Przykład rozpuszczalnego w wodzie polihydroksyfullerenu SGF. Środek: Organicznie rozpuszczalny ester SGF. Po prawej: C74, przykład fullerenu obecnego w niefunkcjonalizowanym SGF.
Oferowane tutaj SGF stanowią trzeci materiał węglowy, po graficie i diamencie, a biorąc pod uwagę znaczenie technologiczne dwóch pierwszych, również dla SGF przewiduje się bardzo świetlaną przyszłość.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?