Metody zwiększania wydajności transdukcji lentiwirusowej
RNAi jest użytecznym narzędziem do analizy funkcjonalnej genów i opracowywania potencjalnej strategii terapeutycznej dla różnych chorób. W przeciwieństwie do mysich systemów retrowirusowych MMLV lub MSCV, cząsteczki oparte na lentiwirusach umożliwiają skuteczną transdukcję i integrację określonego konstruktu shRNA do zróżnicowanych i nie dzielących się komórek.1 Podczas gdy inkubacja pseudotypu lentiwirusa z glikoproteiną G z wirusa pęcherzykowego zapalenia jamy ustnej (VSV-G) i komórek w obecności polibreny może skutecznie służyć jako metoda transdukcji dla wielu typów komórek, niektóre komórki są trudniejsze do transdukcji. W związku z tym wprowadzono modyfikacje do protokołów transdukcji dla trudnych do transdukcji linii, takich jak komórki T, w celu ułatwienia wiązania białka otoczki wirusowej z komórkami. Niektóre z tych modyfikacji obejmują spinokulację, 2 transdukcję magnetyczną (patrz MISSION® ExpressMag® linia produktów), transdukcję komórek na płytkach pokrytych fibronektyną,3 oraz inkubacja komórek ze skoncentrowanymi cząsteczkami wirusa4 (większą lub równą 108 TU/ml). Poniżej przedstawiono protokół spinokulacji, który okazał się skuteczny w transdukcji pseudotypowanego lentiwirusa VSV-G w komórkach Jurkat. Protokół został przeprowadzony równolegle z całonocną inkubacją wirusa z komórkami w obecności polibreny i z transdukcją przeprowadzoną na płytkach pokrytych fibronektą.
Czytaj więcej
Materiały i metody
Wielokrotność infekcji (MOI) 0.1, 0.5, 1.0, 5.0 i 10.0 przy użyciu MISSION® TurboGFP™ Control Transduction Particles (nr produktu. SHC003V) dodano do 2 × 105 komórek Jurkat w 2,0 ml kompletnej pożywki (RPMI 1640, 2 mM L-glutaminy, 1.5 g/l wodorowęglanu sodu, 4,5 g/l glukozy, 10 mM HEPES, 1,0 mM pirogronianu sodu, 10% płodowej surowicy bydlęcej) dla trzech testowanych metod transdukcji. Komórki odwirowywano z prędkością 800 × g przez 30 minut w temperaturze 32 ºC. Pożywkę zawierającą wirusa odsysano, a osady dysocjowano przez pipetowanie w 2,0 ml kompletnej pożywki do transdukcji przez spinokulację. Następnie komórki umieszczono w 6-dołkowych płytkach i inkubowano w temperaturze 37°C, 5% CO2 inkubatorze przez noc. Roztwór podstawowy superfibronektyny (nr produktu S5171) rozcieńczono w sterylnym PBS do końcowego stężenia 5 μg/ml i dodano 3,0 ml na studzienkę do każdej studzienki 6-dołkowych płytek poddanych działaniu hodowli tkankowej. Następnie płytki inkubowano w temperaturze 37 °C przez 1,5 godziny. Każdą studzienkę przepłukano dwukrotnie 2,0 ml pełnej pożywki przed dodaniem komórek. Komórki i cząsteczki wirusa umieszczono następnie w 6-dołkowych płytkach i inkubowano w temperaturze 37°C, 5% CO2 inkubatorze przez noc. Transdukcje przeprowadzane przez inkubację komórek i wirusa wykonywano przez dodanie cząstek wirusa do pełnej pożywki zawierającej 8 μg/mL polibreny i komórek. Każda próbka była delikatnie mieszana przez pipetowanie. Komórki i cząstki wirusa umieszczono w 6-dołkowych płytkach i inkubowano w temperaturze 37 °C, 5% CO2 inkubatorze przez noc. Po około 18 godzinach inkubacji wszystkie transdukowane komórki odwirowano, a pożywkę zmieniono na świeżą kompletną pożywkę. Trzy dni po transdukcji, wszystkie próbki zostały osuszone, jak opisano powyżej i ponownie zawieszone w świeżej pełnej pożywce zawierającej 2 μg/mL puromycyny. Wraz z transdukowanymi kulturami, nietransdukowana kultura została posiana w pożywce zawierającej puromycynę, aby służyć jako kontrola do oceny, kiedy transdukowane kultury wyłoniły się z selekcji. Komórki inkubowano przez noc, jak opisano powyżej. Wszystkie próbki odwirowano jak poprzednio, a pożywkę zmieniono na kompletną pożywkę zawierającą 2 μg/ml puromycyny. Komórki były następnie inkubowane przez dodatkowe 48 godzin, aż do całkowitego wyjścia z selekcji, co zostało odnotowane przez śmierć komórek z powodu puromycyny, która nie była już widoczna, oraz przez całkowitą śmierć studzienki nietransdukowanej. Porcję komórek dodano do równej objętości błękitu trypanu (0,4%) i policzono komórki.
Wyniki i dyskusja
We wszystkich trzech testowanych metodach transdukcji żywotność komórek określona przez wykluczenie barwnika błękitu trypanu była większa lub równa 98%. Ponadto, dla wszystkich trzech testowanych metod transdukcji, liczba komórek przeżywających selekcję puromycyną wzrastała liniowo wraz ze wzrostem MOI od 1 do 10. Spinokulacja była najskuteczniejszą metodą transdukcji komórek Jurkat (Rysunek 1), skutkując ponad połową pierwotnej gęstości posiewu w siódmym dniu po transdukcji. Przy niższych MOI można zaobserwować jedynie minimalne różnice między różnymi metodami transdukcji. Przy wyższych MOI obserwuje się bardziej dramatyczny efekt, przy czym fibronektomia powoduje około 50% wzrost liczby przeżywających komórek w porównaniu z polibreną, podczas gdy spinokulacja generuje około pięciokrotny wzrost liczby przeżywających komórek w porównaniu z polibreną.

Rysunek 1. Transdukcja Jurkat różnymi metodami.Wykres przedstawia liczbę żywotnych komórek Jurkat wynikającą z porównania trzech metod transdukcji lentiwirusowej i późniejszej selekcji puromycyną. Komórki policzono w siódmym dniu po transdukcji.
Wnioski
Chociaż spinokulacja okazała się najbardziej wydajną metodą transdukcji dla komórek Jurkat, ważne jest, aby pamiętać, że metoda transdukcji wybrana przez badaczy będzie zależna od typu komórek, a jedna metoda może działać dobrze dla określonego typu komórek, ale może być nieoptymalna dla innego. Należy zauważyć, że w przypadku metody spinokulacji czas wirowania i zastosowana siła g mogą zostać zwiększone, aby potencjalnie zwiększyć wydajność transdukcji2 w niektórych typach komórek. Aby określić, jak łatwo jest transdukować określony typ komórek, należy rozpocząć od zakresu MOI przy użyciu wirusa kontrolnego, takiego jak MISSION® Non-Target shRNA Control Transduction Particles (nr produktu SHC002V), i inkubować komórki i wirusa w obecności polibreny przez noc. Jeśli skuteczność transdukcji jest niska przy użyciu tej metody, należy wykonać sugerowane powyżej modyfikacje protokołu transdukcji. Wszystkie powyższe metody ułatwiają wiązanie białek otoczki wirusa z komórkami, co jest pierwszym etapem transdukcji. Jurkat to powszechnie stosowana linia komórek zawiesinowych, a ulepszone protokoły transdukcji w tej linii będą prawdopodobnie rozszerzalne na inne typy komórek.
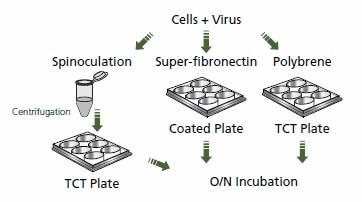
Rysunek 2. Transdukcja lentiwirusowa.Schemat przedstawiający proces transdukcji wirusa w komórkach przy użyciu spinokulacji i różnych powłok płytek.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?