Najnowsze, odporne na powietrze, wilgoć i stabilne termicznie kompleksy sprzęgania krzyżowego
Wprowadzenie do rozwoju prekatalizatorów Buchwald
W ciągu ostatniej dekady grupa Buchwalda opracowała serię wysoce aktywnych i wszechstronnych prekatalizatorów palladowych z odpowiedniej rodziny ligandów dwuarylofosfinowych. Związki te są powszechnie określane jako prekatalizatory i ligandy Buchwalda i stały się cennym zestawem narzędzi do stosowania w reakcjach sprzęgania krzyżowego do tworzenia wiązań C-C, C-N, C-O, C-F, C-CF3 i C-S.1,2,3,4 Ligandy są bogate w elektrony i wysoce przestrajalne, aby zapewnić układy katalityczne o zróżnicowanym zakresie, wysokiej stabilności i reaktywności.
Prekatalizatory Buchwalda obecnej generacji są stabilne w powietrzu, wilgoci i termicznie oraz wykazują dobrą rozpuszczalność w popularnych rozpuszczalnikach organicznych. Zastosowanie tych prekatalizatorów w reakcjach sprzęgania krzyżowego zazwyczaj pozwala badaczowi na użycie mniejszego obciążenia katalizatora i skutkuje krótszymi czasami reakcji. Dodatkowo, ich zastosowanie zapewnia wydajne i szybkie wytwarzanie aktywnych form katalitycznych, zazwyczaj bez środków redukujących, i pozwala dokładnie kontrolować stosunek ligandu do palladu. Unikalne cechy prekatalizatorów doprowadziły do odkrycia nowych metod, które w przeciwnym razie nie byłyby możliwe przy użyciu tradycyjnych źródeł Pd.1,2

Rysunek 1.Cztery generacje prekatalizatorów Buchwalda z ciągłymi ulepszeniami w zakresie łatwości ich aktywacji.
Prekatalizatory Buchwalda pierwszej generacji (G1) pozwoliły na łatwiejsze generowanie aktywnego Pd(0), wymagając jedynie deprotonacji zasadą. Otrzymany katalizator jest bardzo aktywny, nawet w temperaturach do -40 °C. Druga generacja (G2) zastąpiła szkielet oparty na fenetyloaminie kompleksu (G1) ligandem opartym na bifenylu. To ulepszenie pozwoliło badaczowi na stworzenie aktywnego gatunku Pd w temperaturze pokojowej ze słabymi zasadami fosforanowymi lub węglanowymi. Katalizatory te okazały się niezwykle skuteczne w osiąganiu różnych sprzężeń Suzuki-Miyaura wśród innych reakcji sprzęgania krzyżowego. Jednak katalizatory wcześniejszej generacji cierpiały z powodu znacznych ograniczeń zarówno w ich syntezie, jak i w zakresie ich zastosowań. Zastąpienie chlorku w prekatalizatorach bardziej wycofującym elektrony, niekoordynującym metanosulfonianem doprowadziło do powstania prekatalizatorów trzeciej generacji (G3), które są najbardziej wszechstronne i są w stanie pomieścić bardzo nieporęczne ligandy, takie jak rodzina BrettPhos (718742). Co więcej, katalizatory te wykazują niezwykle długą żywotność w roztworze.

Rysunek 2.Prekatalizator Buchwald G3
Podczas aktywacji, deprotekcja prekatalizatora G3 daje kompleks Pd-amido, który następnie redukcyjnie eliminuje, dając aktywny LPd(0), sól metanosulfonianową i karbazol. W niektórych rzadkich przypadkach karbazol może hamować katalizę, zużywając cenne surowce reakcyjne, a także komplikując obróbkę/oczyszczanie. Dodatkowo, śladowe ilości resztkowych pierwszorzędowych aminobifenyli mogą stanowić potencjalne zagrożenie dla zdrowia w zastosowaniach farmaceutycznych. Aby obejść te problemy, grupa Buchwald zmodyfikowała katalizator G3 poprzez metylowanie grupy aminowej szkieletu bifenylu. Te prekatalizatory czwartej generacji (G4) wykazują wyższą rozpuszczalność w reakcjach sprzęgania krzyżowego, zachowując jednocześnie doskonałą aktywność katalityczną.

Rysunek 3.Prekatalizator Buchwald G4
Zalety prekatalizatorów Buchwalda G3 i G4 w porównaniu do wcześniejszych generacji
- Ilościowe generowanie aktywnego katalizatora Pd(0)
- Dostosowuje się do szerszego zakresu ligandów
- Katalizatory G3 są kompatybilne z rodziną BrettPhos i wyjątkowo nieporęcznymi t fosfinami Bu
- Zwiększona stabilność w roztworze, w porównaniu do prekatalizatorów G1 i G2
- Prekatalizatory G4 generują mniej inwazyjny produkt uboczny N-metylokarbazolu
.Reprezentatywne zastosowania sprzęgania i zakres reakcji
Prekatalizatory G3 i G4 są skuteczne w sprzęganiu Suzuki-Miyaura niestabilnych kwasów boronowych, które są powszechnie podatne na protodeboronację. Sukces tego procesu sprzęgania zależy od bardzo szybkiej aktywacji prekatalizatora w połączeniu z wysokim poziomem aktywności katalitycznej. Prekatalizator XPhos Pd G3 (763381) łączy niestabilne kwasy boronowe z bogatymi w elektrony, sterycznie utrudnionymi i heteroarylowymi chlorkami w łagodnych warunkach (rt do 40 °C) z krótkim czasem reakcji (30 minut) i z wysoką wydajnością. Podobnie, prekatalizator XPhos Pd G4 (804274) z powodzeniem dostarcza biaryle z bardzo wysokimi wydajnościami.

Schemat 1.Prekatalizator XPhos Pd G3 i G4 w reakcji sprzęgania Suzuki-Miyaura
Wysokoaktywny prekatalizator XantPhos Pd G4 (900329) nadaje się do niskotemperaturowych aminokarbonylacji bromków (hetero)arylowych w celu syntezy trudnych produktów z bardzo dobrą wydajnością przy niewielkim nadmiarze CO.
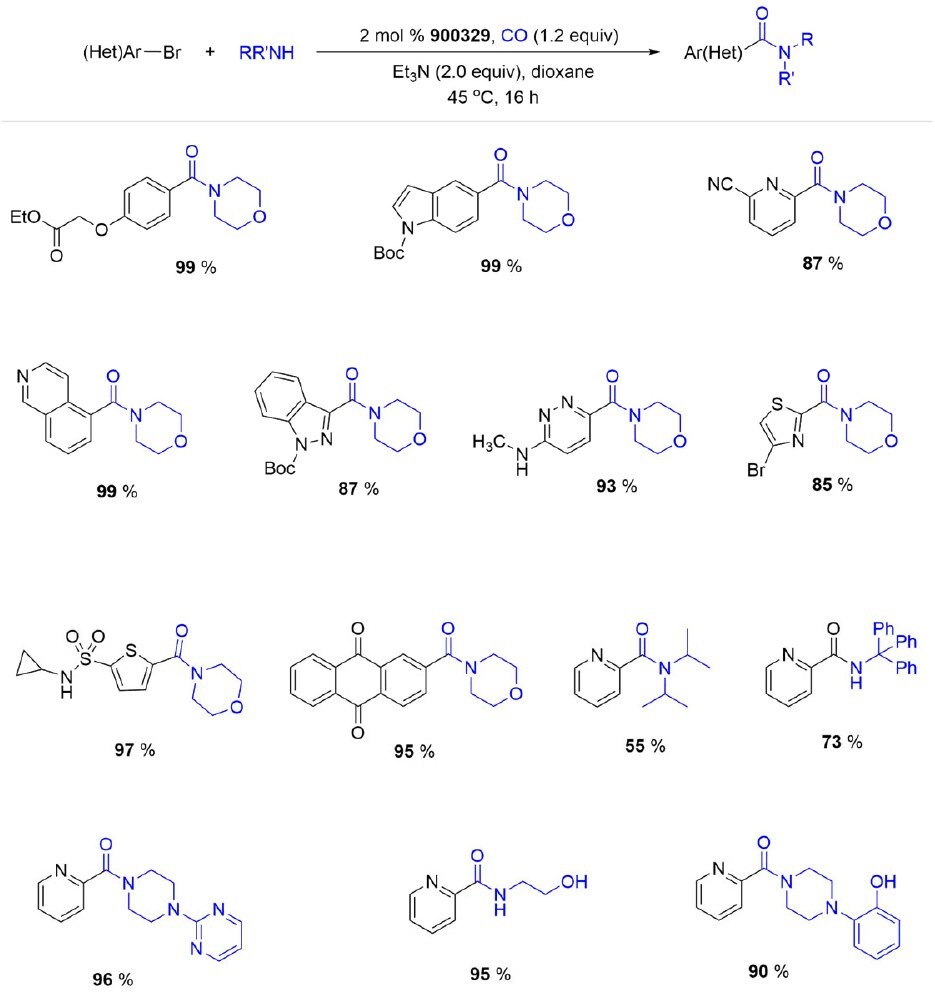
Schemat 2.Aminokarbonylacje bromków (hetero)arylowych przy użyciu XantPhos Pd G4.
EPhos Pd G4 (901220) jest prekatalizatorem z wyboru do katalizowanego palladem krzyżowego sprzęgania C-N między pierwszorzędowymi aminami i halogenkami arylowymi w syntezie funkcjonalizowanych 4-aryloaminotiazoli i 2-aryloaminooksazoli.

Schemat 3.Katalizowane przez EPhos Pd G4 krzyżowe sprzęganie 2-aminooksazoli z halogenkami arylowymi.
VPhos Pd G4 (901218) wraz z układem kwas oktanowy/oktanian sodu umożliwia szybką syntezę szerokiego spektrum alkilowanych rusztowań z odczynników alkilocynkowych. Jest on powszechnie stosowany do katalizowania reakcji sprzęgania krzyżowego Lipshutz-Negishi halogenków alkilowych z elektrofilami arylowymi.

Schemat 4.Katalizowane przez VPhos Pd G4 krzyżowe sprzęganie halogenków alkilowych z elektrofilami arylowymi.
(t-Bu)PhCPhos Pd G3 (900534) jest hybrydowym (alkilo)arylowym prekatalizatorem.) jest hybrydowym (alkilo)arylowym ligowanym prekatalizatorem, zwykle preferowanym do arylowania wysoce utrudnionych α,α,α-trisubstytuowanych amin pierwszorzędowych z różnymi (hetero)arylowymi chlorkami i bromkami.

Schemat 5.Katalizowana przez (tBu)PhCPhos Pd G3 arylacja amin pierwszorzędowych z przeszkodami
Prekatalizator RockPhos Pd G3 (773905) wykazał użyteczność w tworzeniu wiązań C-O, łącząc pierwszorzędowe alkohole alifatyczne z halogenkami arylowymi z dobrą lub doskonałą wydajnością.

Schemat 6.RockPhos Pd G3 katalizuje krzyżowe sprzęganie C-O halogenków arylowych z alkoholami pierwszorzędowymi.

Schemat 7.BrettPhos Pd G3 i G4 katalizowały arylację pierwszo- i drugorzędowych amin.
Jeszcze bardziej masywny t prekatalizator BuBrettPhos Pd G3 (745979) jest bardzo wydajny w arylacji pierwszorzędowych amidów i tolerancyjny na pewną różnorodność funkcjonalną. Katalizator łatwo aryluje amid, ale jest odporny na konkurencyjne arylowanie indolu i niezabezpieczonej grupy alkoholowej w badanych substratach. Dodatkowo, ten wszechstronny prekatalizator palladowy jest doskonałym wyborem do krzyżowego sprzęgania C-O halogenków arylowych z szerokim spektrum alkoholi pierwszorzędowych, metanolu i etanolu.Co ciekawe, pozwala on również na krzyżowe sprzęganie wodorotlenków potasu i cezu z halogenkami (hetero)arylowymi, dając hydroksylowane heteroareny z dobrymi lub doskonałymi wydajnościami.
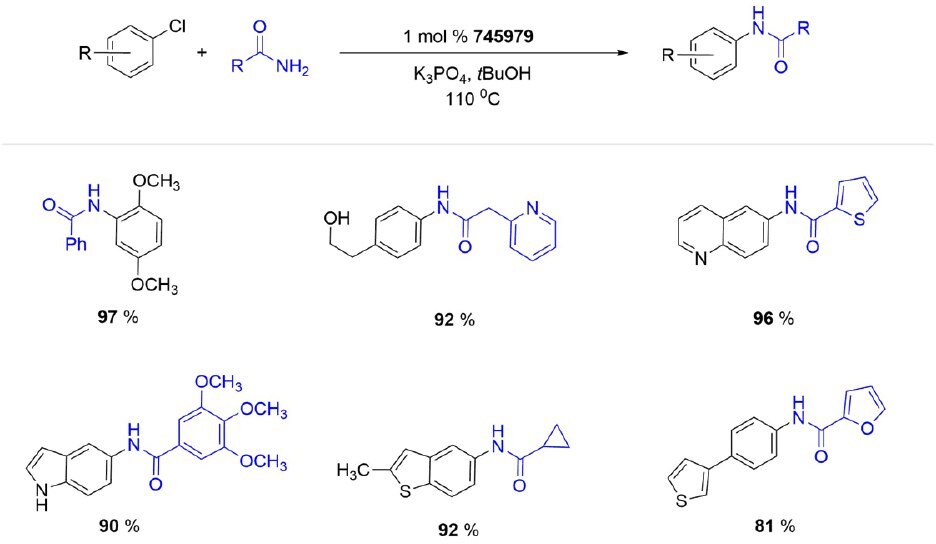
Schemat 8.a. Arylacja amidów katalizowana tBuBrettPhos Pd G3

Schemat 8.b.Aminokarbonylacja bromków (hetero)arylowych katalizowana tBuBrettPhos Pd G3
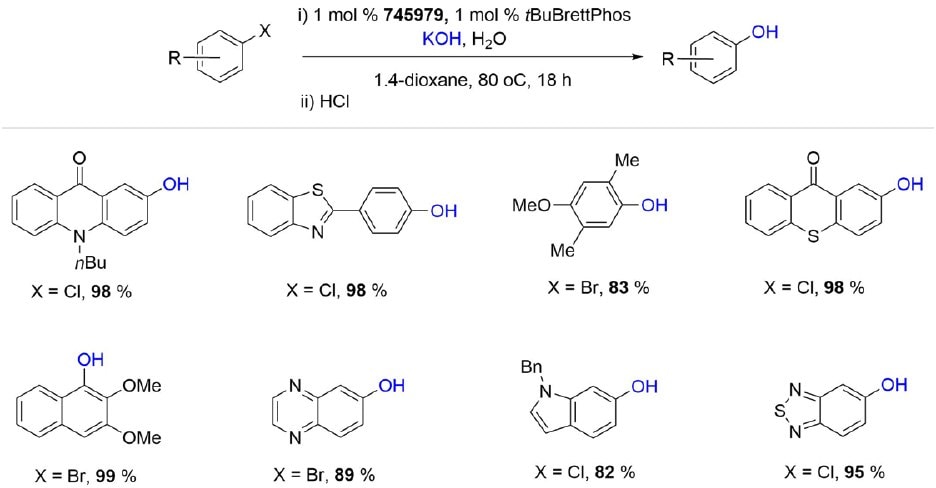
Schemat 8.c.Hydroksylacja halogenków arylowych i heteroarylowych katalizowana tBuBrettPhos Pd G3
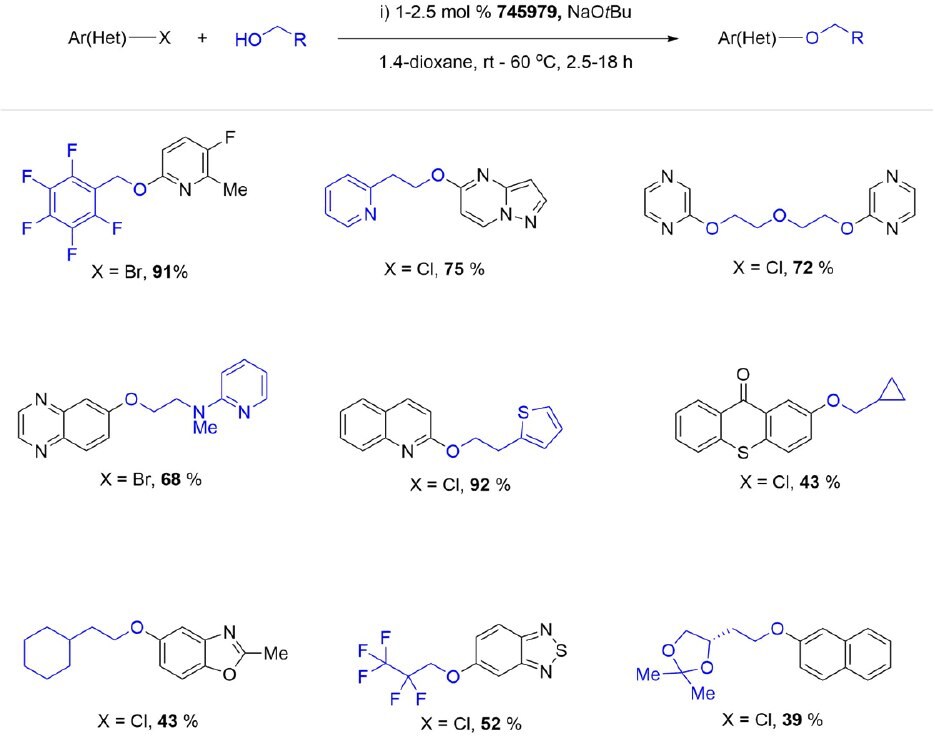
Schemat 8.d.Katalizowane przez tBuBrettPhos Pd G3 krzyżowe sprzęganie C-O alkoholi pierwszorzędowych.
AdBrettPhos Pd G3 (776106) z nieporęczną grupą adamantanową jest wysoce wydajnym prekatalizatorem do selektywnego aminowania szerokiej gamy pięcioczłonowych halogenków heteroarylowych w celu syntezy różnych aminopodstawionych pirazoli, benzotiazoli, indazoli i imidazoli.

Schemat 9.AdBrettPhos Pd G3 katalizował arylację amoniaku pięcioczłonowymi halogenkami heteroarylowymi.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?