Organokatalizatory Jørgensena
Wprowadzenie
Profesor Karl Anker Jørgensen i jego grupa opracowali (R)- i (S)-α,α-bis[3,5-bis(trifluorometylo)fenylo]-2-pirolidynometanol eter trimetylosililowy, które służą jako doskonałe chiralne organokatalizatory w bezpośredniej asymetrycznej α-funkcjonalizacji aldehydów.
W dziedzinie syntezy asymetrycznej ta stereoselektywna funkcjonalizacja z pewnością stanowi ważny przełom. Wykazano, że odczynniki eteru diarylowego diarylprolinolu Jørgensena katalizują różnorodne reakcje tworzenia wiązań, takie jak C-C, C-N, C-O, C-S i C-Hal z wysoką wydajnością i doskonałym poziomem enancjokontroli.

Rysunek 1.pirolidynometanol trimetylosililowy
Reprezentatywne zastosowania
α-Aminacja
Donoszono, że bezpośrednia α-aminacja pomiędzy aldehydami i azodikarboksylanami w temperaturze pokojowej z użyciem organokatalizatora Jørgensena dorównuje enancjoselektywności osiąganej przy użyciu l-proliny jako katalizatora. Co ciekawe, aminowane produkty miały odwróconą konfigurację absolutną, mimo że konfiguracja absolutna katalizatora jest taka sama, ze względu na ekranowanie steryczne.

Rysunek 2.α-Aminacja
Domino Conjugated Nucleophilic Addition-Electrophilic Amination
Prostym podejściem do wysoce sfunkcjonalizowanych cząsteczek jest opracowany przez Jørgensena wieloskładnikowy protokół domino sprzężonej nukleofilowej addycji-elektrofilowego aminowania. Procedura ta zapewnia dostęp do pochodnych 1,2-aminotiolu z enancjoselektywnością na poziomie 99% ee. Miękki nukleofil siarkowy najpierw reaguje z jonem iminowym utworzonym przez α,β-nienasycony aldehyd, a następnie dodaje elektrofil (tj. azodikarboksylan) do półproduktu enaminowego, dając prawie enancjooczyszczone produkty, gdy jako katalizator zastosowano 2-[bis(3,5-bistrifluorometylofenylo)trimetylosilanyloksy-metylo]pirolidynę.

Rysunek 3.Sprzężona addycja nukleofilowa Domino
Asymetryczne epoksydowanie
Oprócz bezpośredniej α-funkcjonalizacji, Jørgensen zgłosił również pierwsze organokatalityczne asymetryczne epoksydowanie α,β-nienasyconych aldehydów przy użyciu swojej sterycznie obciążonej chiralnej pochodnej pirolidyny w przyjaznych dla środowiska warunkach reakcji (np. nadtlenek wodoru jako utleniacz). Seria różnie podstawionych enaliów została przekształcona w odpowiednie α,β-epoksydowe aldehydy z wydajnością do 90%, diastereoselektywnością do 98:2 i enancjoselektywnością do 98%.
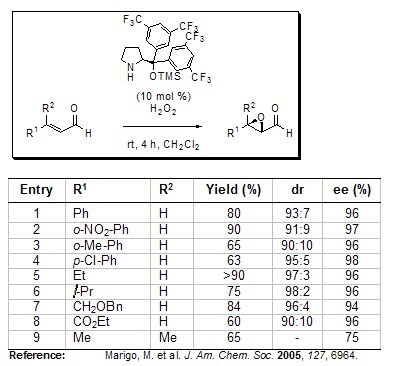
Rysunek 4.Epoksydacja asymetryczna
Asymetryczna hydrofosfinylacja
Bardzo niedawno Melchiorre i Córdova opracowali jednocześnie pierwszą organokatalityczną asymetryczną hydrofosfinylację α,β-nienasyconych aldehydów, umożliwiającą bezpośredni dostęp do wysoce enancjowzbogaconych β-fosfinowych aldehydów. Korzystnie, w przeciwieństwie do procesu katalizowanego metalem, wariant organokatalityczny nie cierpi z powodu inhibicji produktu wynikającej ze zdolności koordynacyjnej atomu fosforu. Chiralne fosfiny mogą dostarczyć, po prostych manipulacjach, cennych bidentnych ligandów P do katalizowanych metalami enancjoselektywnych transformacji.

Rysunek 5.Asymetryczna hydrofinylacja
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?