HumanKine® Termostabilny bFGF
Nick Asbrock, Christine Chen, Vi Chu
MilliporeSigma, Temecula, CA, USA
Wprowadzenie
Fibroblast growth factors (FGFs) są wydzielanymi glikoproteinami, które regulują kilka podstawowych szlaków rozwojowych i pomagają regulować patterning mezodermy i ektodermy we wczesnym rozwoju embrionalnym. U osób dorosłych FGF uczestniczą w kilku procesach fizjologicznych i patologicznych, w tym w proliferacji komórek, ich przeżyciu, różnicowaniu, gojeniu ran i regulacji angiogenezy. Proces sygnalizacji FGF obejmuje ich wiązanie z receptorami FGF (FGFR) na powierzchni komórek. Zidentyfikowano 23 różne FGF, które wywierają swoje działanie poprzez cztery główne typy FGFR związanych z kinazą tyrozynową, które oznaczono jako FGFR1, FGFR2, FGFR3 i FGFR4. Po związaniu ligandu receptory te ulegają dimeryzacji, co skutkuje aktywacją ich domen kinazy tyrozynowej i międzycząsteczkową transfosforylacją.
Podstawowy FGF, znany również jako bFGF lub FGF-2, należy do grupy strukturalnie homologicznych FGF, które charakteryzują się wiązaniem heparyny i aktywnością mitogenną na różnych komórkach pochodzenia mezodermalnego i neuroektodermalnego. Zastosowanie bFGF w biologii komórek macierzystych jest powszechne i jest krytycznym czynnikiem wzrostu, który umożliwia ekspansję wielu komórek macierzystych w ich stanach pluripotencjalnych lub multipotencjalnych. Kilka ostatnich badań sugeruje istotną rolę sygnalizacji FGF/kinazy regulowanej sygnałem zewnątrzkomórkowym (Erk) w promowaniu przejścia ze stanu naiwnego do zagruntowanego stanu różnicowania oraz w zapobieganiu powrotowi zagruntowanych komórek do stanu naiwnego. Sygnalizacja FGF w efekcie stabilizuje stan primed ludzkich embrionalnych komórek macierzystych. Ze względu na jego szybką degradację w temperaturze 37 °C, wielu badaczy komórek macierzystych dodaje wysokie poziomy bFGF do swoich pożywek i wymaga uciążliwej, częstej wymiany pożywek.
HumanKine® Thermostable bFGF to zmodyfikowana rekombinowana wersja ludzkiego bFGF. Jest on generowany poprzez selektywną zmianę sekwencji aminokwasów w celu zwiększenia jego termostabilności w porównaniu do bFGF typu dzikiego. To humanizowane rekombinowane białko jest wytwarzane przy użyciu zastrzeżonego systemu ekspresji ludzkich komórek i jest oznaczone jako produkt wolny od kseno. Wykazaliśmy, że to unikalne białko ma zwiększoną stabilność w temperaturze 37 °C, jednocześnie posiadając zwiększoną funkcjonalność biologiczną zarówno na ludzkich komórkach iPS, jak i populacjach ludzkich nerwowych komórek macierzystych. Zastosowanie tego produktu zmniejszy zmienność powszechnie obserwowaną w wielu hodowlach komórek macierzystych oraz skróci czas i koszty potrzebne do hodowli tych wymagających komórek.
Metody
Określanie stabilności cytokin bFGF w podwyższonych temperaturach
Stabilność normalnych i HumanKine® termostabilnych białek rekombinowanych bFGF analizowano w temperaturze 37 °C przez okres 7 dni. Normalny bFGF lub HumanKine® Thermostable bFGF rozcieńczono w 20% pożywce KOSR do końcowego stężenia 150 ng/ml. Próbki pozostawiono w temperaturze 37 °C na okres jednego tygodnia z zatrzymaniem w różnych punktach czasowych w tym okresie. Poziom pozostałego bFGF określano ilościowo w każdym punkcie czasowym przy użyciu ilościowego zestawu ELISA bFGF.
Hodowla ludzkich komórek iPS
Ludzkie komórki iPS zostały wygenerowane z noworodkowych ludzkich fibroblastów napletka przy użyciu zestawu do przeprogramowania lentiwirusowego STEMCCA™, a następnie wycięcia transgenów przy użyciu przepuszczalnej dla komórek Cre-Recombinase. Wolne od transgenów komórki iPS utrzymywano w pożywce KOSR ze standardowym bFGF (10 ng/ml) na pierwotnych mysich fibroblastach embrionalnych przez 20 pasaży przy użyciu ręcznej techniki pasażowania, aż do wykorzystania w eksperymentach. Przy 21 przejściu, ludzkie komórki iPS zostały ręcznie przeniesione do pożywki KOSR bez FGF, KOSR + normalny bFGF (10 ng/ml) lub pożywki KOSR + termostabilny bFGF (10 ng/ml) w duplikatach po około 50 kolonii/basenik z obecnymi komórkami zasilającymi. Komórki karmiono co trzeci dzień przez jeden pasaż w powyższych warunkach, a następnie utrwalano i poddawano działaniu anty-Oct-4 i anty-TRA-1-60 w celu immunobarwienia. Całkowita liczba zróżnicowanych kolonii została policzona ręcznie w dniu 7.
Expansion of ENStem™-A human neural progenitors
Komórki ENStem™-A w pasażu 20 rozmrożono na płytkach pokrytych matrycą Matrigel (1:50) w pożywce do ekspansji neuronalnej ENStem™-A ze standardowym bFGF (20 ng/ml) lub HumanKine® Thermostable bFGF (20 ng/ml). Komórki pasażowano przy użyciu odczynnika Accutase™, a po osiągnięciu 80% konfluencji w trzech pasażach, poddano je immunobarwieniu markerami neuronalnych komórek macierzystych anty-nestyna i anty-Sox-2.
W celu oceny proliferacji, 5x104 komórek wysiano na 6-dołkowe płytki pokryte matrycą Matrigel (1:50) w dwóch powtórzeniach w pożywce do ekspansji neuronalnej ENStem™-A + standardowy bFGF (20 ng/ml) lub pożywce do ekspansji neuronalnej ENStem™-A + termostabilny bFGF (20 ng/ml). Komórki hodowano przez 6 dni bez wymiany pożywki. Komórki odłączono, a potrójne próbki zmieszano z błękitem Trypana i policzono za pomocą hemocytometru w dniach 2, 4 i 6.
Wyniki
Eksperymenty termostabilności
Badaliśmy stabilność termiczną normalnego bFGF i zmodyfikowanego, termostabilnego bFGF w temperaturze 37 °C przez okres siedmiu dni (Rysunek 2). Obniżenie poziomu normalnego bFGF było bardziej wyraźne (prawie 95% redukcji w dniu 1) w porównaniu do termostabilnego bFGF (tylko ~60% redukcji w dniu 1). Oba bFGF wykazywały stopniowy spadek w okresie 7 dni; jednak przy wolniejszym tempie spadku z termostabilnym bFGF.

Rysunek 2. Zwiększona stabilność termostabilnego bFGF w 37 °C w porównaniu z normalnym bFGF.
Eksperymenty z ludzkimi komórkami iPS
Kiedy zastosowaliśmy ograniczony harmonogram karmienia do hodowli ludzkich komórek iPS i użyliśmy termostabilnego bFGF, zaobserwowaliśmy podwyższone poziomy markerów pluripotencji Oct-4 i TRA-1-60 po 7 dniach i znaczące zmniejszenie spontanicznego różnicowania ludzkich komórek iPS w porównaniu do sytuacji, gdy użyliśmy normalnego bFGF w tym samym harmonogramie karmienia (Ryc. 3 i 4). W rzeczywistości nie stwierdziliśmy znaczącego zmniejszenia liczby spontanicznie zróżnicowanych kolonii podczas stosowania normalnego bFGF w porównaniu z samą pożywką KOSR (Rysunek 4).
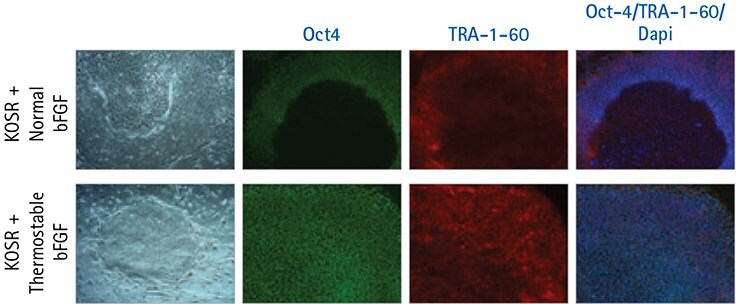
Rysunek 3. Termostabilny bFGF wspomaga pluripotencjalny wzrost ludzkich komórek iPS przy użyciu reżimu karmienia co trzy dni.
Ludzkie komórki iPS hodowane w pożywce HumanKine® Thermostable bFGF po ograniczonym schemacie żywienia wykazują podwyższony poziom markerów pluripotencji Oct-4 (zielony) i TRA-1-60 (czerwony) po 7 dniach. Ludzkie komórki IPS hodowane na pożywce KOSR z normalnym bFGF po ograniczonym schemacie żywienia spontanicznie różnicują się w centrum kolonii i nie wyrażają tych samych jednolitych poziomów ekspresji Oct-4 i TRA-1-60.

Rysunek 4. Ludzkie komórki iPS wykazują niższe poziomy spontanicznego różnicowania przy zastosowaniu schematu karmienia co trzy dni w połączeniu z HumanKine® Thermostable bFGF.
Eksperymenty z ludzkimi neuralnymi komórkami macierzystymi ENStem™-A
Aby ustalić, czy termostabilny bFGF może również ułatwić hodowlę neuralnych komórek progenitorowych, najpierw hodowaliśmy je z termostabilnym bFGF przy użyciu normalnego harmonogramu karmienia (Rysunek 5). Immunocytochemia i mikroskopia jasnego pola wykazały, że komórki po trzech pasażach wykazywały prawidłową morfologię i ekspresję markerów neuronalnych komórek macierzystych Sox-2 i nestyny.

Rysunek 5. Neuronalne komórki progenitorowe ENStem™-A hodowane przez 3 pasaże w HumanKine® Thermostable bFGF zgodnie z normalnym schematem żywienia wykazują prawidłową morfologię i wyrażają markery neuronalnych komórek macierzystych Sox-2 i Nestin. Komórki wybarwione nestyną zostały wybarwione przeciwbarwnikiem jądrowym DAPI (niebieskim).
Następnie zmierzyliśmy proliferację neuronalnych komórek progenitorowych, utrzymując je w minimalnym harmonogramie karmienia, w którym komórki były inkubowane przez sześć dni bez żadnych zmian pożywki. Po sześciu dniach w hodowlach zawierających termostabilny bFGF było nieco więcej komórek na studzienkę w porównaniu z normalnym bFGF (Rysunek 6).

Rysunek 6. Wyższe wskaźniki proliferacji ludzkich neuronalnych komórek progenitorowych ENStem™-A przy zastosowaniu ograniczonego schematu żywienia przy użyciu termostabilnego bFGF w porównaniu z normalnym bFGF. (A) Przebieg czasowy pokazujący liczbę komórek w dniach 2, 4 i 6 inkubacji. (B) Porównanie liczby komórek na studzienkę po sześciu dniach inkubacji bez wymiany pożywki. Eksperymenty przeprowadzono przy użyciu trzech powtórzeń dla każdego punktu czasowego i warunków hodowli.
Dyskusja
Fibroblast growth factor odgrywa kluczową rolę w utrzymaniu embrionalnych komórek macierzystych i komórek iPS w proliferacyjnym, niezróżnicowanym stanie. Podstawowy FGF jest zwykle dodawany do pożywki hodowlanej w celu podtrzymania fosforylacji ERK i ekspresji Nanog1. Poziomy bFGF wymagane do podtrzymania pluripotencji przez pewien okres czasu są około 10-krotnie wyższe niż te wymagane dla innych typów komórek2. Chen i wsp. wykazali, że kwaśny FGF jest wysoce niestabilny w temperaturze 37 °C i nie utrzymuje fosforylacji ERK i pluripotencji w komórkach macierzystych1. Podobne zjawisko zostało zasugerowane dla bFGF. Jednak ich badania wykazały, że w temperaturze 37 °C bFGF ulega agregacji, zmniejszając w ten sposób jego biologiczną dostępność w celu utrzymania pluripotencji.
Zgodnie z tymi wskazaniami, nasze dane sugerują, że HumanKine® Thermostable bFGF może być stosowany z ludzkimi ESC, iPS i neuralnymi komórkami macierzystymi w celu utrzymania ich w stanie pluripotencjalnym i multipotencjalnym jako bardziej skuteczna alternatywa dla normalnego bFGF. Ponadto, ze względu na zwiększoną stabilność, termostabilny bFGF pozwala na mniej rygorystyczny harmonogram karmienia, zwiększając elastyczność eksperymentalną tych modeli komórkowych.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?