Wykrywanie nowotworowych komórek macierzystych przy użyciu przesuniętej ku czerwieni sondy fluorescencyjnej dla dehydrogenazy aldehydowej (ALDH), AldeRed™ 588-A.
Nick Asbrock1, Konstantin Taganov1, Vi Chu1, Martin G. Pomper2, Il Minn2, Haofan Wang2, Steven D. Leach2
1Assay & Platform Development, Bioscience BU, MilliporeSigma, 28820 Single Oak Drive, Temecula, CA, USA 9259, 2Johns Hopkins Russel H. Morgan Department of Radiology and Radiological Science, Baltimore, Maryland 21287, USA.
Wprowadzenie
Rakowe komórki macierzyste (CSC) to subpopulacje komórek nowotworowych, które mogą się odnawiać, generować różnorodne komórki w masie guza i podtrzymywać proces nowotworzenia. Niektórzy badacze uważają, że rak powstaje z nowotworowych komórek macierzystych, które powstają w wyniku mutacji normalnych komórek macierzystych. Wysoka aktywność ALDH służy jako uniwersalny marker komórek macierzystych, zarówno prawidłowych, jak i złośliwych. Komórki mogą być identyfikowane i izolowane na podstawie aktywności enzymatycznej ALDH, enzymu detoksykującego odpowiedzialnego za utlenianie niebezpiecznych aldehydowych produktów ubocznych. Marker ALDH został wykorzystany do izolacji nowotworowych komórek macierzystych z różnych ludzkich nowotworów złośliwych, w tym pęcherza moczowego, piersi, szyjki macicy, okrężnicy, głowy i szyi, wątroby, płuc, trzustki, prostaty i jajnika. W przeszłości selekcja komórek pozytywnych pod względem aktywności dehydrogenazy aldehydowej (ALDH) na zielonym tle fluorescencyjnym była trudna przy użyciu istniejących odczynników.
Zestaw do wykrywania AldeRed™ ALDH zapewnia naukowcom zajmującym się nowotworami i komórkami macierzystymi nowe możliwości izolacji i charakteryzacji komórek na żywo. Odczynnik AldeRed™ jest przesuniętym ku czerwieni fluorescencyjnym substratem dla dehydrogenazy aldehydowej (ALDH), umożliwiającym identyfikację i izolację nowotworowych komórek macierzystych za pomocą cytometrii przepływowej z jednoczesnym wykorzystaniem zielonych fluorescencyjnych linii komórkowych, przeciwciał, zwierząt transgenicznych i testów reporterowych.
Pomper MG et al. A red-shifted fluorescent substrate for aldehyde dehydrogenase. Nat Commun. 2014 Apr 23;5:3662.

Rysunek 1. Mechanizm działania AldeRed™. AldeRed™ 588-A jest fluorescencyjnym i nietoksycznym substratem ALDH, który swobodnie dyfunduje do nienaruszonych i żywych komórek, ale pozostaje uwięziony wewnątrz komórek po przekształceniu przez ALDH w odpowiedni kwas. Ilość wytwarzanej fluorescencji jest proporcjonalna do aktywności ALDH w komórkach i jest mierzona za pomocą cytometrii przepływowej, umożliwiając sortowanie komórek aktywowane fluorescencją (FACS). Aby uzyskać optymalne wzbudzenie i emisję AldeRed™ 588-A, należy użyć kombinacji niebieskiego lasera (488 nm) lub zielonego lasera (532 nm) z detektorem PE-Texas Red (615 nm).
Metody
Wykrywanie populacji nowotworowych komórek macierzystych metodą cytometrii przepływowej z użyciem AldeRed™ 588-A
A) Przygotowanie odczynnika
Przygotowanie buforu testowego AldeRed™
- Odmierz 1 ml buforu testowego AldeRed™ z jednej z czterech butelek dostarczonych z zestawem i dodaj go do jednej z czterech fiolek zawierających proszek werapamilu. Dobrze wymieszaj przez worteksowanie fiolki przez 2-3 minuty i przenieś roztwór z powrotem do tej samej butelki z buforem testowym AldeRed™. Oznaczyć odpowiednio butelkę.
Uwaga: Bufor testowy AldeRed™ należy uzupełnić inhibitorem wypływu werapamilem, aby zapobiec wypływowi produktu reakcji AldeRed™ 588-A i utracie fluorescencji.
Uwaga: Bufor testowy AldeRed™ uzupełniony werapamilem może być przechowywany w temperaturze 2-8 °C przez okres do 3 miesięcy.
Przygotowanie odczynnika AldeRed™ 588-A
- Odczekaj, aż wszystkie odczynniki osiągną temperaturę pokojową.
- Dodaj 25 μL DMSO do fiolki z suchym odczynnikiem AldeRed™ i dobrze wymieszaj. Spodziewaj się, że fioletowy osad zmieni się w czerwony roztwór po dodaniu DMSO.
- Dodaj 25 μL 2N HCl i dobrze wymieszaj. Inkubować mieszaninę przez 15 minut w temperaturze pokojowej.
- Dodaj 360 μL buforu testowego AldeRed™ uzupełnionego werapamilem do fiolki i wymieszaj.
- Przechowywać AldeRed 588-A w temperaturze 2-8 °C podczas użycia.
Uwaga: Pobrać pozostałą ilość AldeRed™ 588-A i przechowywać w temperaturze -20 °C w ciemności. Unikać powtarzających się cykli zamrażania i rozmrażania.
B) Przygotowanie próbki komórek macierzystych
- W zależności od typu komórek, z którymi pracujesz (adherentne, zawiesina, świeże lub zamrożone) postępuj zgodnie ze standardową procedurą, aby zawiesić komórki w pożywce wzrostowej i policzyć. Dostosuj liczbę komórek, osusz komórki i zastąp podłoże wzrostowe 1 ml buforu testowego AldeRed™ uzupełnionego werapamilem.
Uwaga: Stężenie komórek może wymagać optymalizacji dla każdego typu komórek (np. optymalne stężenie komórek SK-BR-3 wynosi 1- 2x105 komórek/mL, Rysunek 2). Testowanie zakresu stężeń komórek jest zalecane w celu określenia najwyższego stosunku sygnału do tła (tj. próbki testowej do próbki kontrolnej traktowanej DEAB).
- Oznacz jedną "testową" i jedną "kontrolną" 1,5 mL probówkę do mikrowirówki dla każdej badanej próbki komórek. Przenieś 1 ml zawiesiny komórkowej z kroku B do odpowiedniej probówki "testowej".
- Dodaj 5 μL odczynnika DEAB do każdej probówki "kontrolnej". Ponownie zamknij probówkę "kontrolną" i fiolkę DEAB, aby zapobiec odparowaniu etanolu.
- Dodaj 5 μL przygotowanego AldeRed™ 588-A z kroku A.5 do probówki "testowej" zawierającej 1 mL zawiesiny komórek. Wymieszaj i natychmiast przenieś 0,5 ml mieszaniny do probówki "kontrolnej" zawierającej DEAB.
- Powtórz kroki C.2-3 dla każdej badanej próbki.
- Inkubuj probówki "testowe" i "kontrolne" w temperaturze 37 °C przez 30-60 minut. Dokładny czas inkubacji może wymagać optymalizacji dla różnych typów komórek.
- Wiruj wszystkie probówki z prędkością 250 x g przez 5 minut i odrzuć supernatant. Zawiesić osad komórkowy w 0,5 ml buforu testowego AldeRed™ uzupełnionego werapamilem i trzymać komórki na lodzie, aby zapobiec wypływowi produktu reakcji ALDH.
- Opcjonalnie: W tym momencie można przeprowadzić immunofenotypowanie nienaruszonych komórek przy użyciu przeciwciał fluorescencyjnych przeciwko markerom powierzchniowym komórek, utrzymując komórki w buforze testowym AldeRed™ uzupełnionym werapamilem na lodzie, aby zapobiec wypływowi produktu reakcji AldeRed™.
D) Analiza cytometrii przepływowej
Uwaga: Dla optymalnego wzbudzenia i emisji AldeRed™ 588-A, należy użyć kombinacji niebieskiego lasera (488 nm) lub zielonego lasera (532 nm) z detektorem PE-Texas Red (615 nm). Wykrywanie w proksymalnych kanałach pomiarowych (np. PE) jest również możliwe, ale może wpływać na delta MFI (średnia intensywność fluorescencji) między próbką testową a próbką kontrolną poddaną działaniu DEAB.
- W zależności od marki i modelu cytometru przepływowego przepływ pracy może się różnić. W trybie konfiguracji dostosuj napięcia i wzmocnienia FSC i SSC przy użyciu próbki "kontrolnej" DEAB i utwórz region (R1), aby objąć zarodkowane komórki.
- Utwórz wykres punktowy AldeRed™ 588-A vs. SSC bramkowany na R1 i dostosuj napięcie tak, aby prawa krawędź populacji komórek próbki "kontrolnej" DEAB znajdowała się w drugiej dekadzie na osi X.
- Uruchom odpowiednią próbkę "testową" i utwórz region R2, który zawiera komórki ALDHHi (Rysunki 2 i 3).
- Przełącz cytometr przepływowy w tryb akwizycji próbek i zbierz dane dla wszystkich próbek "kontrolnych" i "testowych".
Wyniki

Rysunek 2. ALDEFLUOR™ i AldeRed™ identyfikują podobne populacje CSC. Wykrywanie ALDH w komórkach SKBR3 przy użyciu testu ALDEFLUOR™ dało 91% populacji komórek ALDHhi przy użyciu kombinacji niebieskiego lasera (488 nm) z detekcją FITC (525 nm). Wykrywanie ALDH w komórkach SKBR3 za pomocą testu AldeRed™ dało 92% populacji komórek ALDHhi przy użyciu kombinacji zielonego lasera (532 nm) z detektorem czerwieni PE-Texas (615 nm).

Rysunek 3. AldeRed™ pozwala na jednoczesne znakowanie populacji CSC przeciwciałami sprzężonymi z FITC. Barwienie komórek SK-BR-3 za pomocą AldeRed™ 588-A i przeciwciała Milli-Mark™ EpCam-FITC (klon mAB8 nr kat. FCMAB264F) daje 54% ALDHhiEpCAMhi.

Rysunek 4. Identyfikacja ALDH CSC w liniach komórkowych raka płaskonabłonkowego głowy i szyi. UM-SCC-47 jest unikalną linią komórkową raka płaskonabłonkowego głowy i szyi wyizolowaną z guza pierwotnego i zawierającą zintegrowany wirus brodawczaka ludzkiego (HPV-16) i charakteryzującą się obecnością subpopulacji nowotworowych komórek macierzystych ALDH+. A) Wykrywanie ALDH w linii komórkowej raka UM-SCC-47 za pomocą AldeRed™ 588-A daje 13% populacji ALDHhi CSC. B) Wpływ inhibitorów szlaków sygnałowych na populacje CSC ALDHi. Komórki UM-SCC-47 traktowano przez 24 godziny 1 uM każdego inhibitora, a aktywność ALDH mierzono za pomocą AldeRed™ 588-A. W szczególności, inhibitor AKT IV (124011) i inhibitor EGFR (324674) zwiększyły ogólną populację CSC pozytywnych pod względem ALDH.
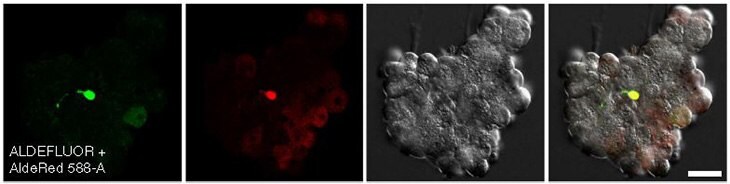
Rysunek 5. Konfokalne obrazy komórek trzustki myszy CA/TD wybarwionych jednocześnie ALDEFLUOR™ i AldeRed™ 588-A.
Znaki towarowe
ALDEFLUOR™ jest zastrzeżonym znakiem towarowym firmy Aldagen Inc.
AldeRed™ jest znakiem towarowym firmy Merck KGaA, Darmstadt, Niemcy i/lub jej spółek zależnych.
.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?