Białka macierzy zewnątrzkomórkowej i narzędzia do optymalizacji hodowli komórkowej
Co to jest macierz pozakomórkowa (ECM)?
Komórki zwierzęce i techniki hodowli tkanek są stale ulepszane w celu optymalizacji warunków hodowli komórek w warunkach in vitro. Powłoki białkowe macierzy zewnątrzkomórkowej (ECM), chemiczna lub fizyczna modyfikacja naczynia do hodowli komórkowej, okazały się skutecznymi metodami lepszego naśladowania zachowania komórek in vivo .
W 1900 roku tkanki zwierzęce hodowano na szklanych powierzchniach, ale ponieważ wymagają one starannych procedur czyszczenia, naukowcy zaczęli eksperymentować z jednorazowymi plastikowymi naczyniami do hodowli wykonanymi z polistyrenu.1,2 Jednak plastikowe naczynia hodowlane mają pewne ograniczenia:3
- Trudności we wzroście i przyłączaniu komórek w pożywkach bez surowicy
- Zmiany kształtu, polaryzacji i morfologii komórek
- Zwiększona proliferacja komórek i zmniejszone różnicowanie
- Mniejsza reaktywność na hormony i czynniki wzrostu
Naukowcy rozpoczęli następnie powlekanie naczyń zarówno materiałami biologicznymi (powłoka biologiczna), jak i syntetycznymi polimerami (powłoka chemiczna), które mogą zwiększać przyczepność, wzrost i różnicowanie komórek. Wzrost komórek na powlekanych powierzchniach jest bardziej odpowiednią reprezentacją środowiska naturalnego w przeciwieństwie do wzrostu komórek na płaskich, dwuwymiarowych powierzchniach z tworzywa sztucznego. Technikę tę można zakwalifikować jako fizjologiczne środowisko 2D lub warunki hodowli komórkowej 2,5D.

Rysunek 1.Komórki w obecności białek macierzy zewnątrzkomórkowej zachowują się fizjologicznie lepiej niż komórki w warunkach 2D.
Komórki hodowane w obecności biologicznej (białka macierzy zewnątrzkomórkowej) lub chemicznej (poli-lizyna...) powłoki podlegają bardziej fizjologicznym zachowaniom niż komórki hodowane w klasycznych warunkach hodowli komórkowej 2D.
ECM Proteins
Tkanki to nie tylko ciasno upakowane komórki; większość objętości zawiera przestrzeń pozakomórkową i jest wypełniona złożoną siatką białek zwaną macierzą pozakomórkową (ECM). składniki ECM w większości tkanek są wydzielane przez fibroblasty i są podzielone na proteoglikany i białka włókniste (kolagen, żelatyna, fibronektyna i laminina).4 Składniki te zapewniają wsparcie strukturalne i ułatwiają komunikację komórkową. Integryny, białka transmembranowe na powierzchni komórek, które łączą cytoszkielet komórek z ECM, aktywują szlaki sygnałowe, które regulują proliferację komórek, morfologię, adhezję i śmierć komórek.
Laminina
Lamina jest głównym składnikiem blaszki podstawnej. Składa się z trzech długich łańcuchów polipeptydowych (oznaczonych jako α, β i γ) połączonych wiązaniami dwusiarczkowymi i ułożonych w asymetryczny kształt krzyża. Laminina działa jak klej, który utrzymuje komórki i ECM razem. Posiada aktywne domeny do wiązania kolagenu, adhezji komórek, wiązania heparyny i fragmentu wzrostu neurytu. Laminina moduluje wzrost komórek, ruchliwość i szlaki sygnałowe3,8.
Fibronektyna
Fibronektyna jest dużą glikoproteiną (220 kDa) składającą się z dwóch łańcuchów polipeptydowych (dimer) połączonych wiązaniami dwusiarczkowymi na jednym końcu. Każdy polipeptyd jest dalej składany w funkcjonalnie i strukturalnie odrębne domeny, które wiążą się z różnymi składnikami ECM (glikozaminoglikanami, proteoglikanami i kolagenem) oraz białkami powierzchniowymi komórek.Fibronektyna jest wydzielana przez szeroką gamę komórek tkanki łącznej, w tym: fibroblasty, chondrocyty, komórki Schwanna, makrofagi, komórki nabłonka jelitowego i hepatocyty7.
.

Rysunek 2. Struktura fibronektyny.
Fibronektyna jest wielofunkcyjnym białkiem zaangażowanym w adhezję i rozprzestrzenianie się komórek. Reguluje również morfologię komórkową, migrację komórek, organizację cytoszkieletu, hemostazę i naprawę ran.

Rysunek 3. Struktura błony podstawnej, w tym białka ECM laminina, kolagen i fibronektyna.
Kolagen
Kolagen jest najobficiej występującym białkiem u ssaków, stanowiącym 25% całkowitej masy białka. Składa się z trzech łańcuchów polipeptydowych (oznaczonych jako łańcuchy alfa) ułożonych w konformacji helikalnej, bogatych w reszty glicyny i proliny. Istnieje ponad 20 różnych typów kolagenów, z których kolagen I, II, III, V i XI to kolagen fibrylarny powszechnie występujący w tkance łącznej. Kolagen typu IX i XII to kolagen związany z fibrylami, który łączy fibryle ze sobą i ze składnikami macierzy zewnątrzkomórkowej. Natomiast kolagen typu IV i VII to kolagen tworzący sieć, który stanowi główną część blaszki podstawnej.5
W tkankach kolagen zapewnia wsparcie strukturalne, wytrzymałość i sprężystość, a w hodowli komórkowej jest wykorzystywany do badania wzrostu, różnicowania i migracji komórek6.
Żelatyna
Żelatyna to heterogeniczna mieszanina rozpuszczalnych w wodzie białek o wysokiej średniej masie cząsteczkowej, która jest obecna w kolagenie. Białka są ekstrahowane poprzez gotowanie odpowiedniej skóry, ścięgien, więzadeł i kości w wodzie. Żelatyna typu A pochodzi z tkanki utwardzanej kwasem, podczas gdy typ B pochodzi z tkanki utwardzanej wapnem.
Żelatyna ze świńskiej skóry, określana jako żelatyna typu A, jest wytwarzana z kwaśnego trawienia kolagenu i składa się głównie z glicyny, proliny i hydroksyproliny. Żelatyna ta wykazuje losową strukturę cewki po trawieniu z potrójnego helikalnego kolagenu, różniąc się od żelatyny bydlęcej typu B w sekwencji N-końcowej.
Żelatyna jest powszechnie stosowana w celu poprawy przyczepności komórek i powlekania płytek lub naczyń do hodowli komórkowych stosowanych do hodowli embrionalnych komórek macierzystych, hodowli komórek jąder i rozetek nerwowych.
Witronektyna
Witronektyna jest glikoproteiną o 459 aminokwasach, występującą w ECM i krwi. Krąży we krwi w postaci pojedynczego łańcucha o masie 75 kDa lub jako dwa łańcuchy o masie 65 kDa i 10 kDa. Witronektyna oddziałuje z polisacharydami (glikozaminoglikanami) i proteoglikanami, działając jako cząsteczka adhezyjna komórek. Chociaż witronektyna i fibronektyna mają podobne funkcje i mają sekwencję rozpoznawania komórek Arg-Gly-Asp, są one strukturalnie i immunologicznie różne.9
Witronektyna działa jako inhibitor cytolitycznego szlaku dopełniacza i odgrywa fizjologiczną rolę w szlaku krzepnięcia. Ponadto promuje migrację komórek, proliferację, różnicowanie i rozprzestrzenianie się komórek śródbłonka i komórek nowotworowych.
Powłoki chemiczne i syntetyczne: Poli-lizyna i poli-ornityna
Powłoki z syntetycznych polimerów (poli-aminokwasów) ułatwiają przyłączanie zarówno komórek, jak i białek. Poli-aminokwasy, takie jak poli-lizyna i poli-ornityna tworzą dodatni ładunek na polistyrenie i zwiększają dodatnio naładowane miejsca dostępne do wiązania komórek.11 Są one również stosowane w połączeniu z czynnikami przyłączeniowymi, które mogą promować elektrostatyczne oddziaływanie między ujemnie naładowanymi jonami na błonie komórkowej i dodatnio naładowanymi jonami czynników przyłączeniowych na powierzchni hodowli.
Gotowe do użycia, wstępnie zmieszane roztwory czynników adhezyjnych
Nasze gotowe do użycia roztwory mieszanek czynników adhezyjnych są przeznaczone do powlekania kolb i płytek do hodowli komórkowych, promując przyłączanie, różnicowanie i proliferację różnych typów komórek, w których adhezja zależy od powierzchni pokrytej ECM. Konwencjonalne metody hodowli komórkowej obejmują czasochłonne etapy przygotowawcze, w tym powlekanie płytek różnymi czynnikami adhezyjnymi, co może wydłużyć ogólny czas badania. Te rozwiązania w zakresie mieszania czynników adhezyjnych pomagają uprościć przygotowanie hodowli komórkowej, zmniejszyć optymalizację użytkownika końcowego, zminimalizować liczbę kroków i potrzebny czas oraz zmniejszyć ilość odczynników do mycia. Naukowcy mogą również zainicjować swoje testy tego samego dnia, co powlekanie płytek, eliminując potrzebę nocnego oczekiwania przed zastosowaniem drugiego czynnika wiążącego. Stężenie robocze mieszaniny czynników adhezyjnych jest wstępnie zoptymalizowane do stosowania w płytkach 10 x 96-dołkowych, eliminując potrzebę rozcieńczania.
Zastosowania mieszaniny czynników adhezyjnych
Połączenie lamininy z poli-l-lizyną (PLL), poli-l-ornityną (PLO) lub poli-d-lizyną (PDL) jest często stosowane do hodowli i promowania przyłączania i różnicowania komórek nabłonkowych i neuronalnych. Mieszanki te mogą być przechowywane w temperaturze pokojowej i są bardziej stabilne w porównaniu do samej lamininy, która wymaga przechowywania w temperaturze -20˚C i jest podatna na denaturację przy powtarzających się cyklach zamrażania-rozmrażania. Gdy komórki mogą trawić poli-L-lizynę, zaleca się stosowanie mieszanki Lamininy z poli-D-lizyną, aby zapobiec nadmiernemu wychwytowi L-lizyny.
Aby zweryfikować skuteczność gotowych do użycia mieszanek Lamininy, neuronalne komórki macierzyste (NSC) hodowano przy użyciu dwóch metod powlekania w celu porównania. W standardowej metodzie, PLL/PLO/PDL i laminina były inkubowane razem, po czym następowało płukanie i druga całonocna inkubacja. Stosując naszą nową uproszczoną metodę, PLL (LPLL001), lub PLO (LPLO001), lub PDL (LPDL001) inkubowano ze wstępnie wymieszanym roztworem do powlekania lamininą przez 1 godzinę w temperaturze 37°C. Wyniki pokazują przyłączenie i proliferację NSC przy użyciu gotowych do użycia mieszanin roztworów powlekających (rysunki 4-6).
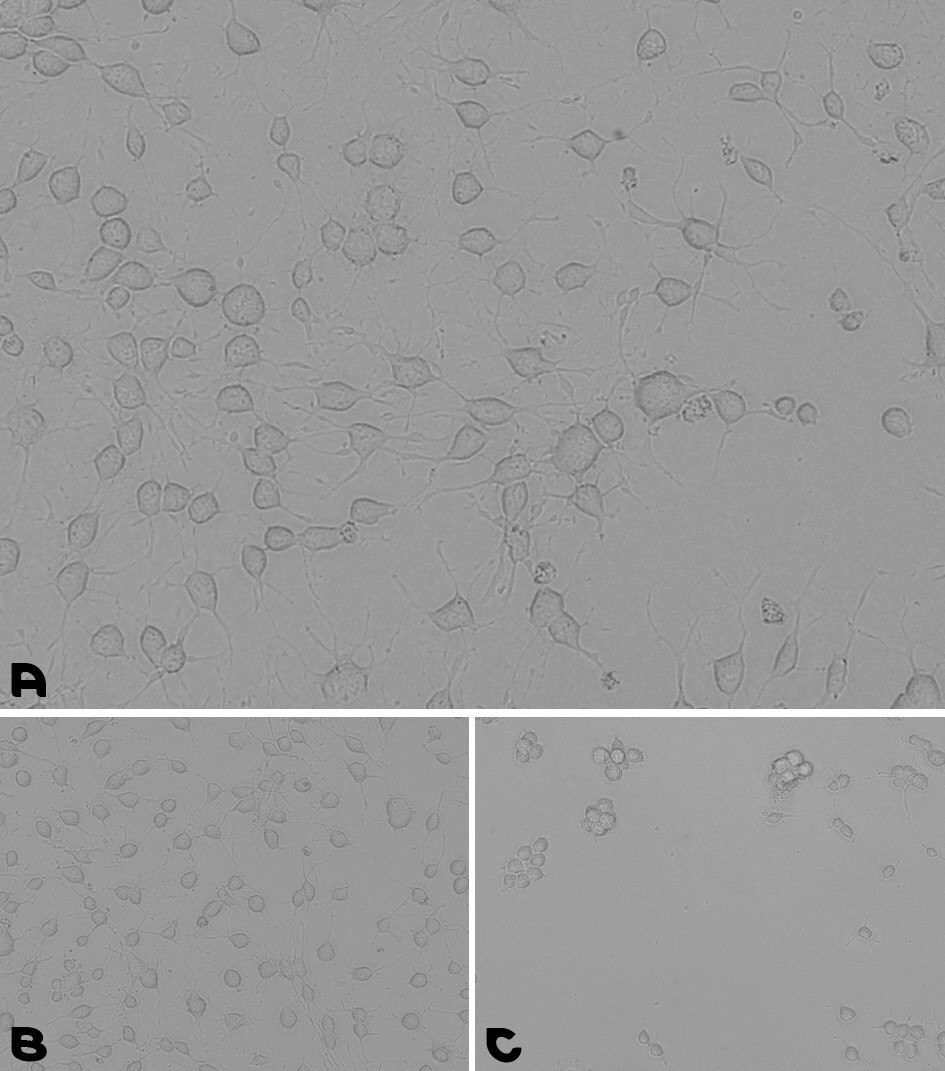
Rysunek 4.Test hodowli neuronalnych komórek macierzystych. A. Powłoka przygotowana przez 1-godzinną inkubację w temperaturze 37°C ze wstępnie zmieszanym roztworem powlekającym lamininy z PDL. B. Powłoka przygotowana przez całonocną inkubację z PDL, a następnie płukanie i drugą całonocną inkubację z Lamininą. C. NSC hodowano przez 48 godzin na płytce TC bez żadnej powłoki.
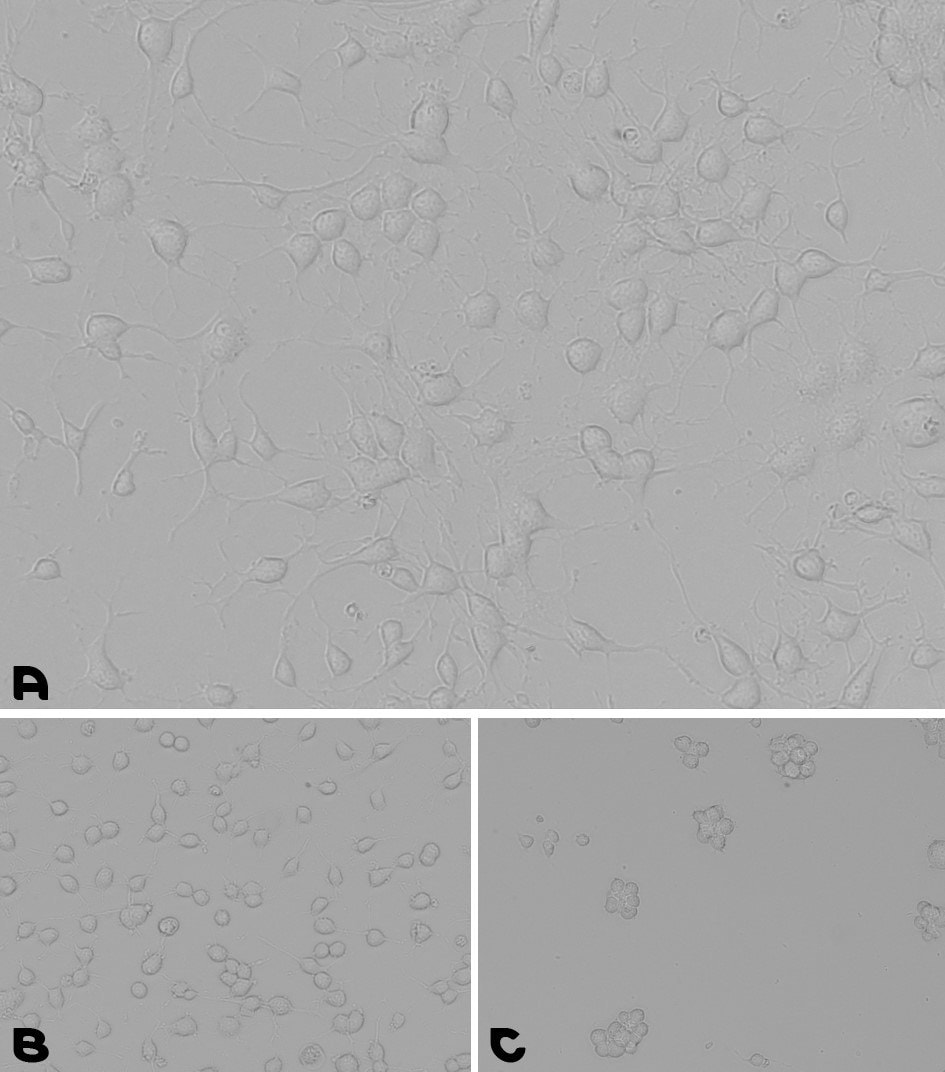
Rysunek 5.Test hodowli neuronalnych komórek macierzystych. A. Powłoka przygotowana przez 1-godzinną inkubację w temperaturze 37°C ze wstępnie zmieszanym roztworem powlekającym lamininy z PLL. B. Powłoka przygotowana przez całonocną inkubację z PLL, a następnie płukanie i drugą całonocną inkubację z Lamininą. C. NSC hodowano przez 48 godzin na płytce TC bez żadnej powłoki.
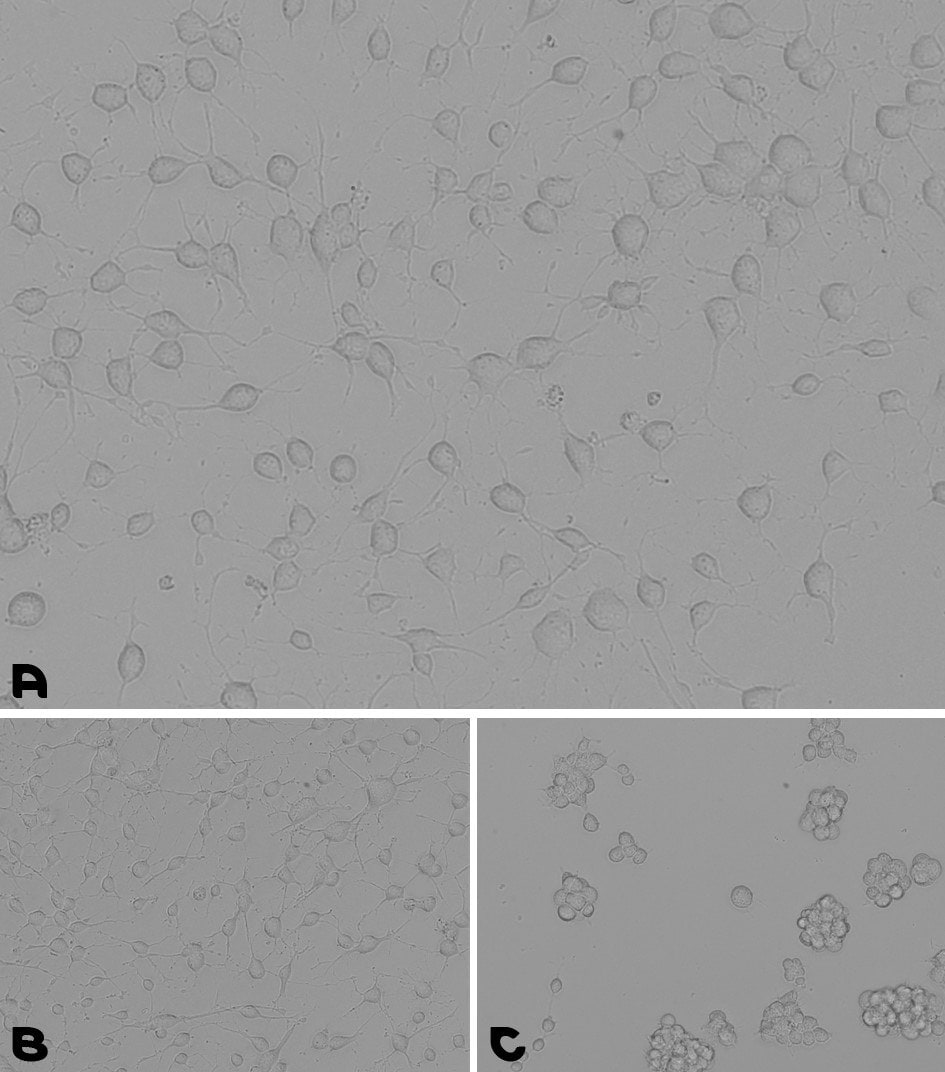
Rysunek 6.Test hodowli neuronalnych komórek macierzystych. A. Powłoka przygotowana przez 1-godzinną inkubację w temperaturze 37°C ze wstępnie zmieszanym roztworem powlekającym lamininy z PLO. B. Powłoka przygotowana przez całonocną inkubację z PLO, a następnie płukanie i drugą całonocną inkubację z Lamininą. C. NSC hodowano przez 48 godzin na płytce TC bez żadnej powłoki.
Nasza mieszanka Fibronektyna - Żelatynowy Roztwór Powlekający jest odpowiednia do stosowania w hodowlach bez surowicy lub z obniżoną zawartością surowicy i jest szczególnie przydatna do hodowli linii komórek mięśnia sercowego HL-1 i komórek śródbłonka.
Na rysunku 7 różne linie komórkowe (komórki BHK21, komórki CHO, komórki F9 i linia komórek mięśnia sercowego HL-1) były hodowane na roztworze powlekającym fibronektyna/żelatyna (FG001). Wszystkie linie komórkowe wykazały doskonałe przyleganie i proliferację, potwierdzając skuteczność gotowego do użycia roztworu powlekającego Fibronektyna - Żelatyna.
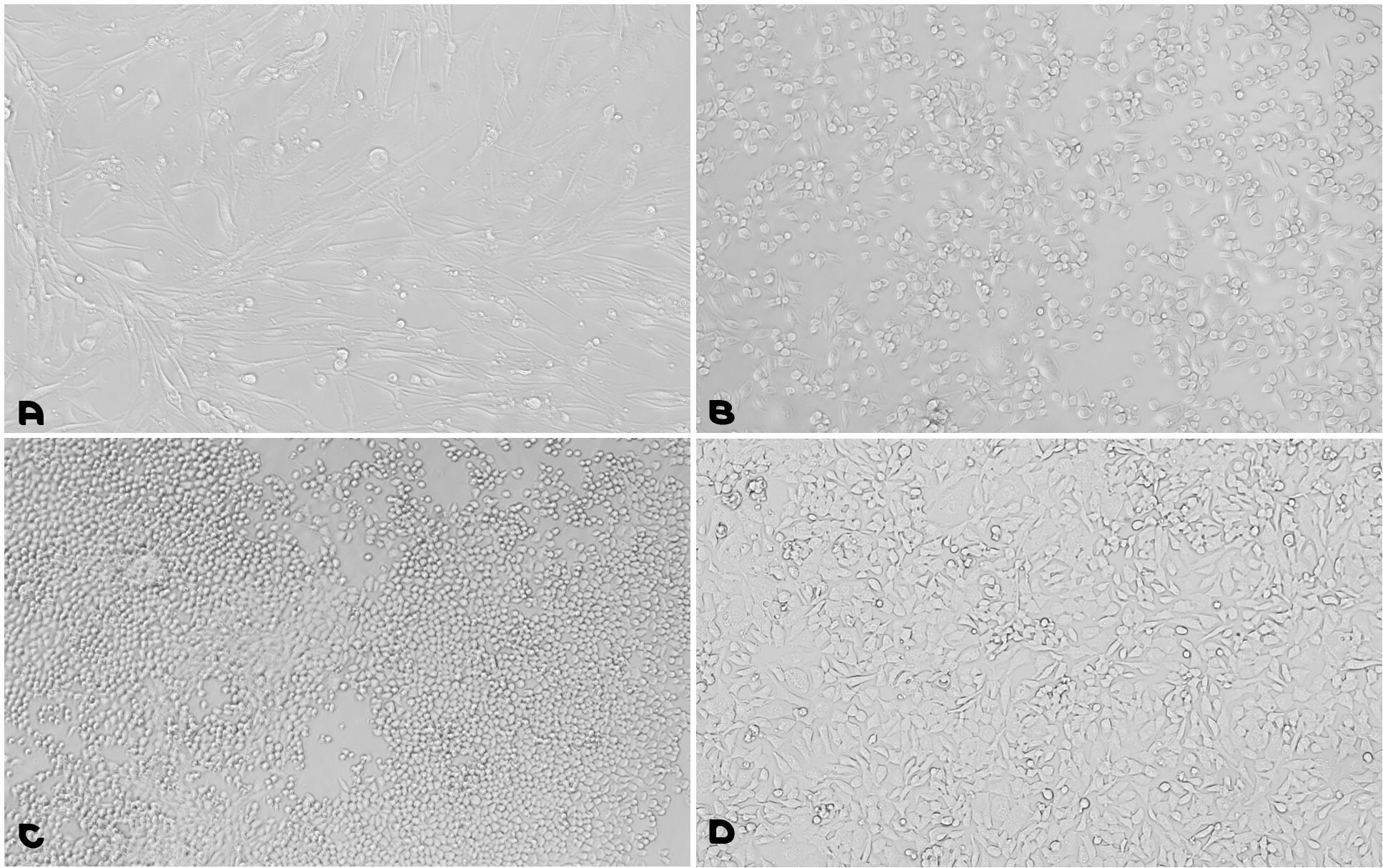
Rysunek 7.Wzrost linii komórkowych przy użyciu roztworu powlekającego fibronektyna-żelatyna. A. Komórki BHK21 (fibroblasty z nerki chomika); B. Komórki CHO (jajnik chomika chińskiego); C. Komórki F9 (mysi rak zarodkowy jądra); D. Linia komórek mięśnia sercowego HL-1 (SCC065).
Nasze gotowe do użycia, wstępnie zmieszane roztwory czynników adhezyjnych oferują oszczędność czasu i wydajną alternatywę dla testów hodowli komórkowych, umożliwiając badaczom rozpoczęcie eksperymentów tego samego dnia, co powlekanie płytek. Dostarczone wyniki eksperymentalne wykazują przydatność tych mieszanin dla różnych typów komórek, co czyni je cennymi narzędziami do usprawnienia i udanych eksperymentów hodowli komórkowej.
Powlekane paski i płytki do adhezji komórek
Paski do adhezji komórek Millicoat®
Paski do adhezji komórek Millicoat® to 12 wymiennych 8-dołkowych pasków, które mieszczą się w ramce płytki, zapewniając wygodę i elastyczność podczas projektowania testów komórkowych. Studzienki w rzędach A-G są wstępnie pokryte białkiem ECM, takim jak fibronektyna lub witronektyna, a rząd H jest pokryty BSA, aby służyć jako kontrola negatywna. Komórki można następnie wysiać na pokrytą powierzchnię, a przylegające komórki można utrwalić i wybarwić.
Płytki CytoSoft
Sztywność podłoża, na którym rosną komórki, wpływa na ich funkcje komórkowe. Płytki CytoSoft® pokryte są cienką warstwą biokompatybilnego silikonu, o różnych sztywnościach obejmujących szeroki zakres fizjologiczny. Powierzchnia żeli tworzy stabilne wiązania kowalencyjne z białkami, ułatwiając powlekanie żelu czynnikami adhezyjnymi (składnikami ECM) i umieszczanie komórek. Płytki CytoSoft® posiadają następujące cechy:
- Optycznie przejrzyste i mają niską autofluorescencję
- Żele silikonowe nie są podatne na hydrolizę
- Żele silikonowe są stabilne, nie wysychają ani nie pęcznieją
- Odporne na rozrywanie lub pękanie
- Sztywność prawie niezmieniona podczas wydłużonych okresów przechowywania<
- Trypsyna i kolagenaza może być używana do pobierania komórek
- Odporny na rozkład biochemiczny po obróbce enzymatycznej
Inne białka ECM w hodowli komórkowej
Pokrycie powierzchni hodowli białkami ECM i syntetycznymi polimerami znacząco wpływa na zachowanie komórek. Obserwowana odpowiedź zależy zarówno od typu komórek, jak i powłoki użytej jako podłoże. Komórki w kontakcie z czynnikami wiążącymi przeżywają dłużej i mogą być również hodowane przy braku czynników surowicy.3 Czynniki wiążące mogą sekwestrować i przechowywać czynniki wzrostu, kontrolując przestrzenno-czasową regulację czynników i ułatwiając krzyżową wymianę między receptorami czynników wzrostu a receptorami ECM. Określają również właściwości mechaniczne i instruują komórki do różnicowania się w sprzyjających warunkach. Białka ECM indukują sygnalizację wewnątrzkomórkową poprzez receptor na powierzchni komórki w synergii z sygnalizacją czynnika wzrostu.12 Ponieważ hodowla komórkowa ewoluuje, potrzeba więcej składników i kombinacji, aby lepiej naśladować warunki tkanek i rozszyfrować język macierzy zewnątrzkomórkowej między komórkami.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?