Sepharose Fast Flow: Oczyszczanie z dobrą rozdzielczością i łatwym skalowaniem
- Używaj podłoża Sepharose Fast Flow do oczyszczania białek.
- Używaj podłoża Sepharose Fast Flow do wychwytywania lub pośrednich etapów oczyszczania, które wymagają dobrej rozdzielczości (przepływy do 300 cm/h).
- Używaj słabego wymieniacza jonowego, takiego jak DEAE, CM lub ANX Sepharose Fast Flow, jeśli silny wymieniacz jonowy (zastąpiony Q, S lub SP) nie zapewnia wymaganej selektywności.
- Uruchamiaj kolumny Sepharose Fast Flow w systemach takich jak ÄKTAdesign, FPLC System i HPLC lub systemach wykorzystujących pompy perystaltyczne.Załącznik 4 zawiera wskazówki dotyczące wyboru najbardziej odpowiedniego systemu ÄKTAdesign.
Podłoża Sepharose Fast Flow są oparte na matrycy 90 μm cząstek wykonanych z 6% agarozy i silnie usieciowanych w celu zapewnienia stabilności chemicznej i fizycznej. ANX Sepharose 4 Fast Flow (high sub) opiera się na 4% agarozie, tworząc podłoże, które utrzymuje wysoką zdolność wiązania podczas oddzielania dużych cząsteczek, takich jak tyreoglobulina (Mr = 650 000), szczególnie nadaje się do produkcji na dużą skalę, gdy całkowita zdolność wiązania staje się ekonomicznie istotna.
Macierze Sepharose Fast Flow są zastępowane szeregiem grup jonowymiennych (Q, DEAE, ANX, SP i CM), co daje możliwość testowania i stosowania różnych selektywności (patrz Rozdział 1 w celu uzyskania wyjaśnień na temat silnych i słabych wymieniaczy jonowych). Wymieniacze jonowe zawierające silne grupy jonowymienne (Q i SP) utrzymują swój ładunek w szerokim zakresie pH, umożliwiając wybór najbardziej odpowiedniego pH dla każdego zastosowania.
Wymieniacze jonowe zawierające słabe grupy jonowymienne (DEAE, CM i ANX) oferują alternatywną selektywność, ale w węższym zakresie roboczym pH. Rysunek 55 ilustruje, jak selektywność nośników Sepharose Fast Flow zmienia się w zależności od grupy anionowymiennej.
Rozmiar cząstek i objętość złoża pozostają stabilne, pomimo zmian siły jonowej lub pH, aby zapewnić szybką separację przy dużych prędkościach przepływu z dobrą rozdzielczością. Metody można łatwo skalować od kolumn takich jak HiTrap Q FF (1 ml, wstępnie zapakowane z Q Sepharose Fast Flow) do kolumn na dużą skalę, takich jak FineLINE. Wydajność nośników Sepharose Fast Flow jest dobrze udokumentowana i istnieje wiele przykładów płynnego przejścia z laboratorium do skali pilotażowej i produkcji.
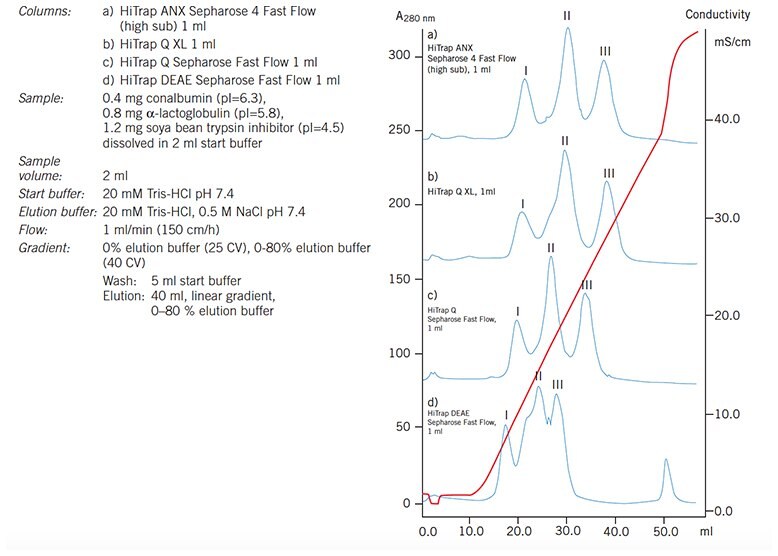
Wykres 55.Separacja konalbuminy (I), a-laktoalbuminy (II) i inhibitora trypsyny sojowej (III) na szeregu anionowymiennych kolumn HiTrap pokazuje różnicę w selektywności w zależności od grupy anionowymiennej.
Opcje oczyszczania
.
Wykres 56.Nośniki Sepharose Fast Flow o różnej selektywności są dostępne w opakowaniach jednostkowych w kolumnach HiTrap i HiPrep oraz w zestawach nośników.
*Patrz Załącznik 5 do przeliczania przepływu liniowego (cm/godz.) na objętościowe natężenie przepływu (ml/min) i odwrotnie.
**Pracujący zakres pH odnosi się do przedziału pH, w którym medium wiąże białko zgodnie z przeznaczeniem lub zgodnie z potrzebami elucji bez niekorzystnych skutków długoterminowych.
***Maksymalne robocze ciśnienie wsteczne odnosi się do ciśnienia, powyżej którego medium zaczyna się ściskać.
- Używaj wstępnie zapakowanych kolumn HiTrap (1 mL lub 5 mL) do wyboru mediów, badania metod, separacji grup, oczyszczania na małą skalę, zagęszczania próbek lub oczyszczania. Połącz szeregowo do 3 kolumn HiTrap w celu zwiększenia skali.
- Używaj wstępnie zapakowanych kolumn HiPrep (20 mL) do opracowywania metod, separacji grupowych, oczyszczania na większą skalę, zagęszczania próbek lub oczyszczania. Połącz kilka kolumn HiPrep szeregowo, aby zwiększyć zdolność wiązania.
W przypadku większych objętości należy wybrać kolumnę produkcyjną, taką jak BPG lub Chromaflow.
Przykłady oczyszczania
Sprawdzanie nośników
Używając kolumn HiTrap o pojemności 1 ml, można szybko i łatwo wybrać najbardziej odpowiednią matrycę i naładowaną grupę do separacji przed optymalizacją i zwiększeniem skali. Na Rysunku 57 porównanie profili elucji dla tej samej próbki rozdzielonej w identycznych warunkach na trzech różnych nośnikach ilustruje różnice w selektywności i rozdzielczości, które mogą wynikać ze zmiany grupy ładunkowej i wielkości cząstek. Najbardziej odpowiedni nośnik można wybrać, a warunki zoptymalizować zgodnie z wymaganiami dotyczącymi separacji, na przykład w celu wyizolowania pojedynczego, dobrze rozdzielonego piku lub zmaksymalizowania rozdzielczości między kilkoma pikami zainteresowania.
Zacznij od zwiadu na silnych wymieniaczach jonowych (Q, S lub SP), aby znaleźć największe różnice w ładunku między cząsteczkami zainteresowania.
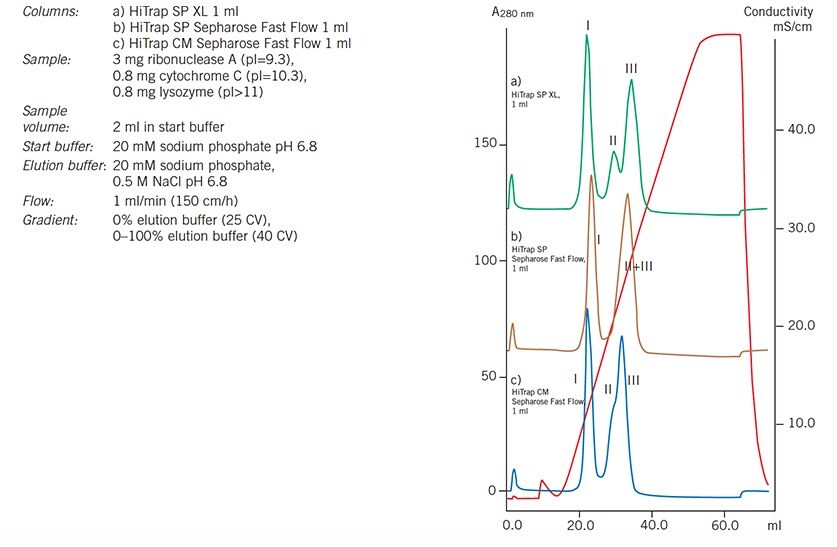
Wykres 57.Badanie pożywek: separacja rybonukleazy A (I), cytochromu C (II) i lizozymu (III) na HiTrap CM Sepharose Fast Flow 1 mL, HiTrap SP Sepharose Fast Flow 1 mL i HiTrap SP XL 1 mL.
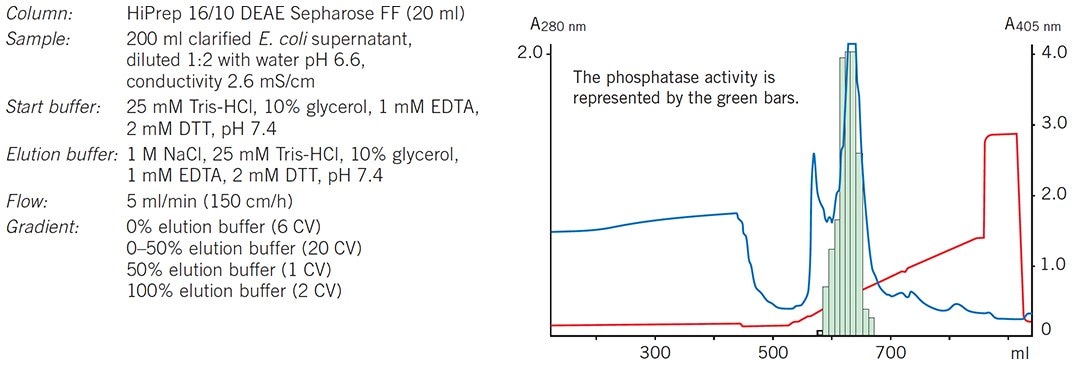
Wykres 58.Kolumna HiPrep 16/10 DEAE Sepharose Fast Flow jest używana jako etap wychwytywania w celu zagęszczenia rFosfatazy i usunięcia większości zanieczyszczeń.
Skalowanie
Rysunek 59 pokazuje łatwość, z jaką separacje mogą być skalowane na kolumnach wypełnionych podłożem Sepharose Fast Flow. Począwszy od kolumny HiTrap o pojemności 1 ml, powtarzalność separacji została utrzymana przez 20-krotne zwiększenie skali.
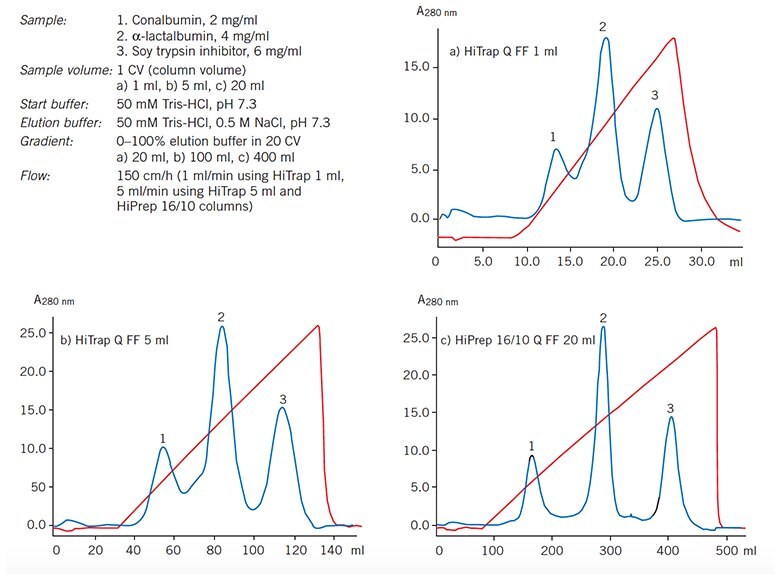
Wykres 59.5-krotne i 20-krotne zwiększenie skali przy użyciu wstępnie zapakowanych kolumn Q Sepharose Fast Flow.
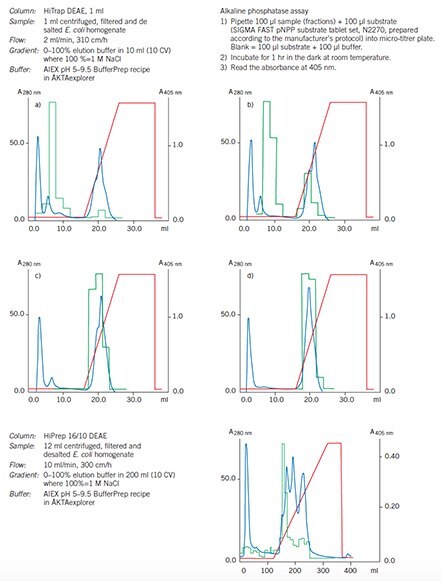
Wykres 60.Optymalizacja i zwiększenie skali na DEAE Sepharose Fast Flow.
Optymalizacja pH
Po wybraniu najbardziej odpowiedniego medium do separacji, warunki mogą być dalej optymalizowane poprzez dostosowanie parametrów, takich jak pH. Rysunek 61 pokazuje, jak zwiększenie pH na kolumnie wstępnie wypełnionej CM Sepharose Fast Flow (HiPrep 16/10 CM FF) znacznie poprawiło rozdzielczość mieszaniny białek modelowych.
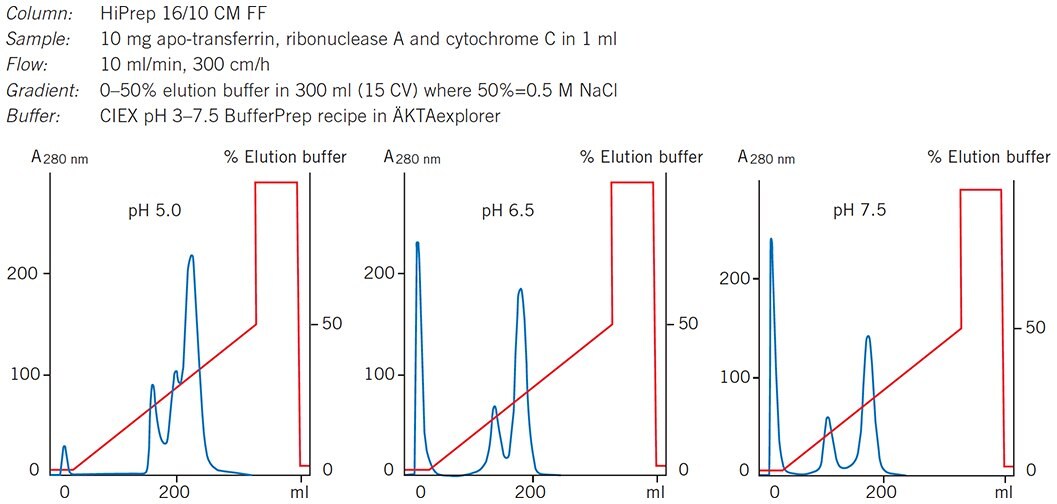
Wykres 61.Wybór optymalnego pH dla separacji standardowych białek na HiPrep 16/10 CM FF.
Stężenie próbki
Zagęszczenie próbki przed filtracją żelową może być korzystne w celu zminimalizowania objętości próbki i ułatwienia szybkiej separacji o wysokiej rozdzielczości. Kolumny HiTrap oferują wygodne, gotowe do użycia rozwiązanie do zagęszczania próbek. Tabela 7 na stronie strona 89 podaje przykłady wysokich współczynników stężenia osiąganych podczas zatężania białek z bardzo rozcieńczonego materiału wyjściowego przy użyciu kolumn HiTrap wstępnie wypełnionych podłożem Sepharose HP. Podobne wyniki można osiągnąć za pomocą kolumn HiTrap wstępnie wypełnionych podłożem Sepharose Fast Flow lub Sepharose XL.
Wykonywanie separacji
Wytyczne dotyczące wyboru podłoża, buforu, pH i siły jonowej oraz optymalizacji metody podano w Rozdział 2.
- Prawidłowe przygotowanie próbki i buforu jest niezbędne do osiągnięcia optymalnego rozdziału i uniknięcia pogorszenia wydajności kolumny. Próbki muszą być w pełni rozpuszczone i wolne od cząstek lub innych materiałów, które mogą zakłócać separację. Patrz Rozdział 2 oraz Załącznik 1 dla zaleceń i porad dotyczących przygotowania próbek.
- Filtruj bufory po dodaniu wszystkich soli i dodatków. Używaj wysokiej jakości wody i chemikaliów. Roztwory należy filtrować przy użyciu filtrów 1 μm lub mniejszych. Aby uniknąć tworzenia się pęcherzyków powietrza w upakowanej kolumnie, bufory i kolumny należy utrzymywać w stałej temperaturze przed i w trakcie pracy.
- PH buforu początkowego powinno wynosić co najmniej 0,5-1 jednostki pH powyżej pI substancji docelowej w przypadku stosowania wymieniacza anionowego (Q, DEAE lub ANX) i 0,5-1 jednostki pH poniżej pI substancji docelowej w przypadku stosowania wymieniacza kationowego (SP, CM). Patrz Załącznik 2 w celu uzyskania zaleceń dotyczących lotnych i nielotnych systemów buforowych dla wymieniaczy anionowych i kationowych.
Dla próbek o nieznanych właściwościach ładunku, wypróbuj następujące metody:
- wymiennik anionowy (Q)
bufor startowy: pH 8.0
bufor elucyjny: bufor startowy zawierający 1 M NaCl, pH 8.0 - wymiana kationów (SP)
bufor startowy: pH 6.0
bufor elucyjny: bufor startowy zawierający 1 M NaCl, pH 6.0
Jeśli selektywność nie jest zadowalająca przy użyciu silnego wymieniacza jonowego (Q lub SP), należy wypróbować słaby wymieniacz jonowy (DEAE, ANX lub CM).
Użytkownicy systemów ÄKTAdesign z funkcją BufferPrep mogą wybrać jedną z receptur buforowych zalecanych do chromatografii anionowymiennej przy pH 8 lub chromatografii kationowymiennej przy pH 6.
Pierwsze użycie lub po długotrwałym przechowywaniu
- Aby usunąć etanol, przepłucz 1 objętość kolumny wodą destylowaną z prędkością 1 ml/min (HiTrap 1 ml), 5 ml/min (HiTrap 5 ml), 2 ml/min (HiPrep 20 ml) lub z prędkością 50 cm/godz. dla Sepharose Fast Flow zapakowanej w większe kolumny. Ten etap zapewnia usunięcie etanolu i pozwala uniknąć ryzyka wytrącenia, jeśli sole buforowe wejdą w kontakt z etanolem. Etap ten można pominąć, jeśli wytrącanie nie stanowi problemu.
- Płukać 5 objętościami buforu startowego z prędkością 1 mL/min (HiTrap 1 mL), 5 mL/min (HiTrap 5 mL) lub 5 mL/min (HiPrep 20 mL).
- Płukanie 5 objętościami buforu elucyjnego w kolumnie, taki sam przepływ jak w kroku 2.
- Płukanie 5 objętościami buforu startowego w kolumnie, taki sam przepływ jak w kroku 2.
- Przeprowadź ślepą elucję przed nałożeniem próbki.
Separacja przez elucję gradientową
Przepływ: 1 mL/min (HiTrap 1 mL), 5 mL/min (HiTrap 5 mL), 5 mL/min (HiPrep 20 mL) lub z prędkością 150 cm/h dla Sepharose Fast Flow upakowanych w większych kolumnach.
- Kolumnę należy skalibrować za pomocą 5-10 objętości buforu startowego lub do momentu, gdy linia bazowa, pH eluentu i przewodność będą stabilne.
- Dostosuj próbkę do wybranego początkowego pH i siły jonowej i nałóż na kolumnę.
- Przepłukać kolumnę 5-10 objętościami buforu startowego lub do momentu, gdy wartość wyjściowa, pH eluentu i przewodność będą stabilne, tj. gdy cały niezwiązany materiał zostanie przepłukany przez kolumnę.
- Rozpocząć elucję przy użyciu gradientu o objętości 10-20 objętości kolumny i rosnącej sile jonowej do 0.5 M NaCl (50%B).
- Przepłukać 5 objętościami kolumny 1 M NaCl (100%B) w celu elucji pozostałego materiału związanego jonowo.
- Wyrównać za pomocą 5-10 objętości kolumny buforu startowego lub do momentu, gdy pH i przewodność eluentu osiągną wymagane wartości.
Separacja przez elucję krokową
Przepływ: 1 mL/min (HiTrap 1 mL), 5 mL/min (HiTrap 5 mL), 5 mL/min (HiPrep 20 mL) lub z prędkością 150 cm/h dla Sepharose Fast Flow upakowanych w większych kolumnach.
- Kolumnę należy skalibrować za pomocą 5-10 objętości buforu startowego lub do momentu, gdy linia bazowa, pH eluentu i przewodność będą stabilne.
- Dostosuj próbkę do wybranego początkowego pH i siły jonowej i nałóż na kolumnę.
- Przepłukać kolumnę 5-10 objętościami buforu startowego lub do momentu, gdy wartość wyjściowa, pH eluentu i przewodność będą stabilne, tj. gdy cały niezwiązany materiał zostanie przepłukany przez kolumnę.
- Eluować 5 objętościami buforu startowego + NaCl o wybranej sile jonowej.
- Powtórzyć krok 4 przy wyższych siłach jonowych, aż docelowe białko (białka) zostanie wymyte.
- Przepłukać 5 objętościami kolumny roztworem o wysokiej zawartości soli (1 M NaCl w buforze startowym) w celu elucji pozostałego materiału związanego jonowo.
- Ponownie skalibrować 5-10 objętości kolumny buforem startowym lub do momentu, gdy pH i przewodność eluentu osiągną wymagane wartości.
- Oszczędzaj czas, stosując wyższe natężenia przepływu podczas etapów płukania i ponownej kalibracji z wysoką zawartością soli.
- Nie przekraczaj maksymalnego zalecanego przepływu dla medium.
- Jeśli użyto detergentów jonowych, przemyj kolumnę 5 objętościami wody destylowanej, a następnie 2 objętościami 2 M NaCl. Ponownie skalibrować za pomocą co najmniej 10 objętości kolumny buforu startowego, aż linia bazowa UV, pH eluentu i/lub przewodność będą stabilne. Rozpuszczalniki organiczne, takie jak etanol, mogą być używane do usuwania niejonowych detergentów. Wybierając rozpuszczalnik organiczny, należy sprawdzić stabilność chemiczną medium, aby określić odpowiednie stężenie.
- Odnieś się do Rozdziału 2 w celu uzyskania porad dotyczących optymalizacji separacji.
- Regularnie sprawdzaj wydajność kolumny, określając wydajność kolumny i symetrię piku.
- Patrz Appendix 3. Należy pamiętać, że nie dotyczy to kolumn HiTrap lub HiPrep.
Czyszczenie
Prawidłowe przygotowanie próbek i buforów oraz zastosowanie płukania o wysokiej zawartości soli (1 M NaCl) na końcu każdej separacji powinno utrzymać większość kolumn w dobrym stanie. Jednak obniżona wydajność, wolne tempo przepływu, rosnące ciśnienie wsteczne lub całkowite zablokowanie wskazują, że medium należy oczyścić przy użyciu bardziej rygorystycznych procedur w celu usunięcia zanieczyszczeń.
Zaleca się odwrócenie kierunku przepływu podczas czyszczenia kolumny, aby zanieczyszczenia nie musiały przechodzić przez całą długość kolumny. Liczba objętości kolumn i czas wymagany dla każdego etapu czyszczenia mogą się różnić w zależności od stopnia zanieczyszczenia. Jeśli procedura czyszczenia w celu usunięcia typowych zanieczyszczeń nie przywróci wydajności kolumny, należy wymienić górny filtr (jeśli to możliwe) przed wypróbowaniem alternatywnych metod czyszczenia. Podczas wymiany filtra należy zachować ostrożność, ponieważ może to wpłynąć na wypełnienie kolumny i zakłócić jej działanie.
Poniższa procedura powinna być satysfakcjonująca dla usunięcia typowych zanieczyszczeń:
- Płukać co najmniej 2 objętościami kolumny 2 M NaCl z prędkością 1 mL/min (HiTrap 1 mL), 5 mL/min (HiTrap 5 mL), 5 mL/min (HiPrep 20 mL) lub z prędkością 40 cm/h z czasem kontaktu 1-2 godzin dla Sepharose Fast Flow zapakowanej w większe kolumny.
- Płukanie co najmniej 4 objętościami kolumny 1 M NaOH (taki sam przepływ jak w kroku 1).
- Płukanie co najmniej 2 objętościami kolumny 2 M NaCl (taki sam przepływ jak w kroku 1).
- Płukać co najmniej 2 objętościami wody destylowanej w kolumnie (taki sam przepływ jak w kroku 1), aż linia bazowa UV i pH eluentu będą stabilne.
- Płukać co najmniej 4 objętościami buforu startowego lub buforu do przechowywania w kolumnie (taki sam przepływ jak w kroku 1), aż pH i przewodność eluentu osiągną wymagane wartości.
Aby usunąć wytrącone białka, lipidy, białka związane hydrofobowo lub lipoproteiny, należy zapoznać się z Załącznik 1.
Charakterystyka nośnika
Skład:
- grupy sulfopropylowe (SP), karboksymetylowe (CM), czwartorzędowe aminowe (Q) lub dietyloaminoetylowe (DEAE) sprzężone z wysoce usieciowaną 6% agarozą poprzez chemicznie stabilne wiązania eterowe.
- grupa dietyloaminopropylowa (ANX) sprzężona z silnie usieciowaną 4% agarozą poprzez chemicznie stabilne wiązania eterowe.
*Długoterminowa stabilność pH odnosi się do przedziału pH, w którym medium jest stabilne przez długi okres czasu bez niekorzystnych skutków ubocznych dla wydajności chromatografii.
Krótkoterminowa stabilność pH odnosi się do przedziału pH dla procedur regeneracji, czyszczenia na miejscu i odkażania.
Wszystkie zakresy są szacunkowe w oparciu o doświadczenie i wiedzę Cytiva.
Stabilność chemiczna
Do codziennego użytku nośniki Sepharose Fast Flow są stabilne we wszystkich powszechnie stosowanych buforach wodnych, 1 M NaOH, środkach denaturujących (8 M mocznik, 6 M chlorowodorek guanidyny), z dodatkami takimi jak niejonowe detergenty, 70% etanol, 1 M kwas octowy i 30% izopropanol. Sepharose Fast Flow można stosować z rozpuszczalnikami organicznymi, takimi jak dimetylosulfotlenek, dimetyloformamid, tetrahydrofuran, aceton, chloroform, dichlorometan, dichloroetan i dichloroetan/pirydyna (50:50), a także z rozpuszczalnikami polarnymi i izolatami wodno-organicznymi. Woda w podłożu może zostać wymieniona przez alternatywny rozpuszczalnik z bardzo niewielkim wpływem na wielkość porów matrycy.
Unikaj kationowych detergentów z SP lub CM Sepharose Fast Flow. Unikać detergentów anionowych z Q, DEAE lub ANX Sepharose Fast Flow. Unikać środków utleniających.
Przechowywanie
W celu przechowywania kolumny, przemyć 2 objętościami wody destylowanej, a następnie 2 objętościami 20% etanolu. Dołącz 0,2 M octan sodu do 20% roztworu etanolu dla SP Sepharose Fast Flow. Odgazuj dokładnie mieszaninę etanolu i wody i stosuj przy niskim natężeniu przepływu, aby uniknąć nadmiernego nacisku na kolumnę. Przechowywać w temperaturze pokojowej lub przez dłuższy czas w temperaturze od +4°C do +8°C. Upewnij się, że kolumna jest dobrze uszczelniona, aby uniknąć wyschnięcia. O ile to możliwe, należy używać urządzenia do przechowywania i transportu dostarczonego przez producenta. Niewykorzystane nośniki należy przechowywać w temperaturze od +4 °C do +30 °C w 20% etanolu. Nie zamrażać.
- Aby uniknąć tworzenia się pęcherzyków powietrza w upakowanej kolumnie, upewnij się, że kolumna i bufory mają tę samą temperaturę podczas przygotowywania do przebiegu.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?