Protokół wyżarzania oligonukleotydów
Ten protokół służy do annealingu dwóch jednoniciowych oligonukleotydów o komplementarnych sekwencjach (Rysunek 1). Ogrzewanie, a następnie chłodzenie ułatwia hybrydyzację.
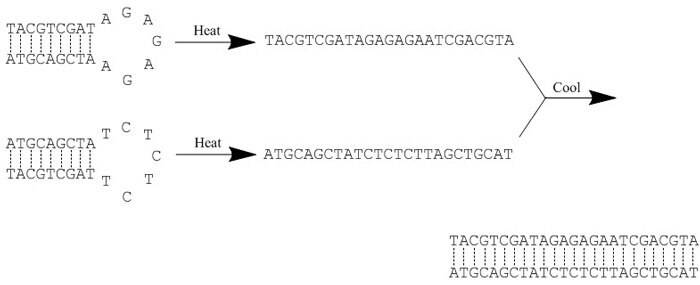
Rysunek 1.Przykład reakcji wyżarzania. Ciepło "przerywa" wszystkie wiązania wodorowe, zakłócając w ten sposób strukturę drugorzędową w każdym oligonukleotydzie. Powolne chłodzenie ułatwia hybrydyzację, ponieważ między komplementarnymi sekwencjami tworzą się nowe wiązania wodorowe.
Definicje / skróty
EDTA: kwas etylenodiaminotetraoctowy
NaCl: chlorek sodu
Trizma® base: Nazwa marki Tris [Tris(hydroksymetylo)aminometan]
Oligo: Skrót od oligonukleotyd lub oligomer. Oligonukleotydy to krótkie, jednoniciowe cząsteczki DNA lub RNA, które muszą zostać wyżarzone (podgrzane lub stopione), aby mogły związać się i utworzyć podwójną nić z odpowiednią komplementarną nicią DNA lub RNA.
Żyłkowanie DNA: Ta strona omawia proces wyżarzania dla wszystkich oligonukleotydów. Czasami wyżarzanie jest określane jako wyżarzanie DNA, mimo że proces ten jest również stosowany w przypadku RNA. Wyżarzanie to proces ogrzewania i chłodzenia dwóch jednoniciowych oligonukleotydów o komplementarnych sekwencjach. Ciepło przerywa wszystkie wiązania wodorowe, a chłodzenie umożliwia tworzenie nowych wiązań między sekwencjami.
Sprzęt i materiały do wyżarzania DNA / RNA
- Blok cieplny lub termocykler
- 2 ml probówki wirówkowe
- .Końcówki do pipet
- Milli-Q® H2O
- EDTA (Product No. E9884)
- NaCl (Nr produktu. S3014)
- Trizma® base (Product No.93362)
- Dwa jednoniciowe oligonukleotydy o komplementarnych sekwencjach
Metoda wyżarzania DNA / RNA
Proces wyżarzania dzieli się na dwa główne etapy: 1) rozpuszczanie i 2) wyżarzanie za pomocą bloku cieplnego lub termocyklera.
Rozpuszczanie oligonukleotydów
Chociaż każdy oligonukleotyd jest dostarczany w odmierzonej ilości, w celu uzyskania najlepszych wyników należy zweryfikować go za pomocą spektrofotometru, aby upewnić się, że do reakcji dodano równe ilości każdego oligonukleotydu.
- Rozpuść każdy oligonukleotyd w pewnej objętości buforu wygrzewającego (patrz przepisy dotyczące buforów poniżej), tak aby każdy z nich miał takie samo stężenie.
- Stężenie każdego oligonukleotydu musi wynosić 2-krotność pożądanego stężenia dupleksu oligonukleotydu.
Przykład
Żądane stężenie dupleksowego oligonukleotydu wynosi 50 µM.
- Oligonukleotyd 1: dostarczony z 10,55 OD (312.6 µg, 49,9 nmol); zweryfikować zmierzoną ilość OD za pomocą spektrofotometru.
- Oligonukleotyd 2: dostarczony z 9,04 OD (279,7 µg, 45,9 nmol); zweryfikować zmierzoną ilość OD za pomocą spektrofotometru.
- Każdy roztwór podstawowy oligonukleotydu musi mieć 2-krotność pożądanego stężenia oligonukleotydu dupleksowego, tj. każdy roztwór podstawowy musi mieć stężenie 100 µM.
- Dla oligonukleotydu 1, dodać 49.9 x 10 = 499 µL buforu wygrzewającego, aby utworzyć roztwór podstawowy o stężeniu 100 µM.
- Dla oligonukleotydu 2, dodaj 45,9 x 10 = 459 µL buforu wygrzewającego, aby utworzyć roztwór podstawowy o stężeniu 100 µM.
*Obliczenie to jest skrótem, który działa tylko w przypadku tworzenia roztworów o stężeniu 100 µM i jest tutaj używany wyłącznie w celach przykładowych. Aby dowiedzieć się więcej na temat obliczania różnych stężeń oligonukleotydów, zobacz Wytyczne dotyczące obsługi i stabilności.
Oligo Annealing
Heat Block
- Zmieszaj równe objętości oligonukleotydów w mikrotubie.
- Inkubować mikrotubę w temperaturze 95°C przez 5 minut.
- Pozwolić mikrotubie powoli ostygnąć do temperatury pokojowej (<60 min).
Termocykler
Chociaż blok cieplny będzie działał, termocykler pozwala na bardziej spójny proces.
- Zmieszaj równe objętości oligonukleotydów w probówce PCR.
- Użyj następującego profilu termicznego:
- Podgrzej do 95 °C i utrzymuj temperaturę przez 2 min.
- Chłodzić do 25 °C przez 45 min.
- Chłodzić do 4 °C w celu tymczasowego przechowywania.
- Podgrzej do 95 °C i utrzymuj temperaturę przez 2 min.
- Krótko odwirować probówkę PCR, aby usunąć całą wilgoć z wieczka.
Po wdrożeniu bloku cieplnego lub termocyklera, dupleks oligonukleotydu jest teraz gotowy do użycia lub przechowywania. Aby dowiedzieć się więcej na temat przechowywania oligonukleotydów, zobacz Wytyczne dotyczące obsługi i stabilności.
Przepisy na bufory do wyżarzania DNA
Wszystkie bufory należy przygotować z użyciem wody Milli-Q® .
Skład buforu wygrzewającego (1X)
- 10 mM Tris, pH 7.5 - 8.0
- 50 mM NaCl
- 1 mM EDTA
Skład buforu ligazowego (1X)
Bufor ten jest zwykle używany z ligazą DNA T4.
- 50 mM Tris-HCl, pH 7.5
- 10 mM MgCl2
- 1 mM ATP
- 10 mM DTT
Skład buforu kinazy (1X)
Bufor ten jest zwykle używany z kinazą polinukleotydową T4.
- 70 mM Tris-HCl, pH 7,6
- 10 mM MgCl2
- 5 mM DTT
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?