Przygotowanie liposomów - lipidy polarne Avanti®
Dr. Stephen Burgess
Chief Scientific Officer at Avanti® Polar Lipids
1. Mechanizm powstawania pęcherzyków
Liposomy (pęcherzyki lipidowe) powstają, gdy cienkie błony lipidowe lub placki lipidowe są uwodnione, a stosy ciekłokrystalicznych dwuwarstw stają się płynne i pęcznieją. Uwodnione arkusze lipidowe odrywają się podczas mieszania i samoczynnie zamykają się, tworząc duże, wielowarstwowe pęcherzyki (LMV), które zapobiegają interakcji wody z węglowodorowym rdzeniem dwuwarstwy na krawędziach. Po uformowaniu tych cząstek, zmniejszenie ich rozmiaru wymaga wkładu energii w postaci energii dźwiękowej (sonikacja) lub energii mechanicznej (wytłaczanie).
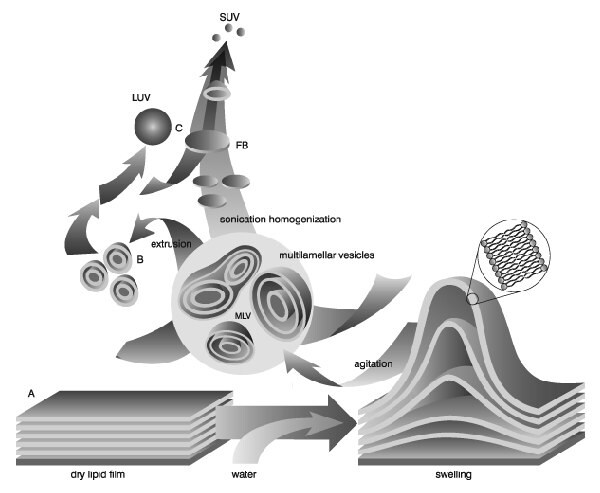
Zdjęcie z Lasic, D.D., Recherche 20, 904, 1989 r.
2. Metoda przygotowania liposomów
Właściwości preparatów lipidowych mogą się różnić w zależności od składu (kationowe, anionowe, neutralne gatunki lipidów), jednak ta sama metoda przygotowania może być stosowana do wszystkich pęcherzyków lipidowych niezależnie od składu. Ogólne elementy procedury obejmują przygotowanie lipidu do hydratacji, hydratację z mieszaniem i sortowanie do jednorodnego rozkładu pęcherzyków.
A. Przygotowanie lipidów do uwodnienia
Przy przygotowywaniu liposomów o mieszanym składzie lipidowym, lipidy muszą być najpierw rozpuszczone i zmieszane w rozpuszczalniku organicznym, aby zapewnić jednorodną mieszaninę lipidów. Zwykle proces ten przeprowadza się przy użyciu chloroformu lub mieszaniny chloroform:metanol. Celem jest uzyskanie klarownego roztworu lipidów w celu ich całkowitego wymieszania. Zazwyczaj roztwory lipidów przygotowuje się w stężeniu 10-20 mg lipidów/ml rozpuszczalnika organicznego, chociaż można stosować wyższe stężenia, jeśli rozpuszczalność lipidów i mieszanie są akceptowalne. Po dokładnym wymieszaniu lipidów w rozpuszczalniku organicznym, rozpuszczalnik jest usuwany w celu uzyskania filmu lipidowego. W przypadku małych objętości rozpuszczalnika organicznego (1 ml), rozpuszczalnik można odparować za pomocą suchego strumienia azotu lub argonu w wyciągu. W przypadku większych objętości rozpuszczalnik organiczny powinien zostać usunięty przez odparowanie obrotowe, uzyskując cienką warstwę lipidową na bokach kolby okrągłodennej. Warstwa lipidowa jest dokładnie suszona w celu usunięcia pozostałości rozpuszczalnika organicznego poprzez umieszczenie fiolki lub kolby w pompie próżniowej na noc. Jeśli użycie chloroformu jest niedopuszczalne, alternatywą jest rozpuszczenie lipidów w trzeciorzędowym butanolu lub cykloheksanie. Roztwór lipidów jest przenoszony do pojemników i zamrażany poprzez umieszczenie pojemników na bloku suchego lodu lub wirowanie pojemnika w kąpieli suchego lodu z acetonem lub alkoholem (etanolem lub metanolem). Podczas korzystania z procedury kąpieli należy zachować ostrożność, aby pojemnik mógł wytrzymać nagłe zmiany temperatury bez pękania. Po całkowitym zamrożeniu, zamrożony placek lipidowy jest umieszczany na pompie próżniowej i liofilizowany do wyschnięcia (1-3 dni w zależności od objętości). Grubość placka lipidowego nie powinna być większa niż średnica pojemnika używanego do liofilizacji. Suche błony lub placki lipidowe można usunąć z pompy próżniowej, pojemnik szczelnie zamknąć i zakleić taśmą, a następnie przechowywać w stanie zamrożonym do czasu gotowości do uwodnienia.

B. Nawodnienie suchego filmu lipidowego/ciastka
Nawodnienie suchego filmu lipidowego/ciastka uzyskuje się po prostu przez dodanie środka wodnego do pojemnika z suchym lipidem i mieszanie. Temperatura medium nawilżającego powinna być wyższa od temperatury przejścia żel-ciecz krystaliczna (Tc lub Tm) lipidu o najwyższym Tc przed dodaniem do suchego lipidu. Po dodaniu medium nawilżającego, zawiesina lipidów powinna być utrzymywana powyżej Tc podczas okresu hydratacji. W przypadku lipidów o wysokiej przemianie można to łatwo osiągnąć, przenosząc zawiesinę lipidów do kolby okrągłodennej i umieszczając kolbę w obrotowym systemie odparowywania bez próżni. Wirowanie kolby okrągłodennej w ciepłej łaźni wodnej utrzymywanej w temperaturze powyżej Tc zawiesiny lipidowej pozwala lipidowi na uwodnienie w fazie płynnej przy odpowiednim mieszaniu. Czas hydratacji może się nieznacznie różnić w zależności od gatunku i struktury lipidów, jednak zaleca się czas hydratacji wynoszący 1 godzinę z energicznym wstrząsaniem, mieszaniem lub mieszaniem. Uważa się również, że pozostawienie zawiesiny pęcherzyków na noc (starzenie) przed zmniejszeniem rozmiaru ułatwia proces wymiarowania i poprawia jednorodność rozkładu wielkości. Starzenie nie jest zalecane w przypadku lipidów o wysokiej przemianie, ponieważ hydroliza lipidów wzrasta wraz z podwyższoną temperaturą.
Środek nawilżający jest generalnie określany przez zastosowanie pęcherzyków lipidowych. Odpowiednie media nawilżające obejmują wodę destylowaną, roztwory buforowe, sól fizjologiczną i nieelektrolity, takie jak roztwory cukru. Fizjologiczna osmolalność (290 mOsm/kg) jest zalecana do zastosowań in vivo. Ogólnie akceptowane roztwory spełniające te warunki to 0,9% sól fizjologiczna, 5% dekstroza i 10% sacharoza. Podczas hydratacji niektóre lipidy tworzą kompleksy unikalne dla ich struktury. Zaobserwowano, że wysoko naładowane lipidy tworzą lepki żel, gdy są uwodnione roztworami o niskiej sile jonowej. Problem ten może zostać złagodzony poprzez dodanie soli lub zmniejszenie rozmiaru zawiesiny lipidów. Słabo uwodnione lipidy, takie jak fosfatydyloetanoloamina, mają tendencję do samoczynnej agregacji po uwodnieniu. Pęcherzyki lipidowe zawierające ponad 60 mol% fosfatydyloetanoloaminy tworzą cząstki o małej warstwie hydratacyjnej otaczającej pęcherzyk. Gdy cząsteczki zbliżają się do siebie, nie ma odpychania hydratacyjnego, które odpychałoby zbliżającą się cząsteczkę, a dwie membrany wpadają do studni energetycznej, gdzie przylegają i tworzą agregaty. Agregaty osadzają się z roztworu w postaci dużych kłaczków, które rozpraszają się podczas mieszania, ale ponownie tworzą się po usadowieniu. Produktem hydratacji jest duży, wielowarstwowy pęcherzyk (LMV) o strukturze analogicznej do cebuli, z każdą dwuwarstwą lipidową oddzieloną warstwą wody. Odstępy między warstwami lipidowymi są podyktowane składem, przy czym warstwy poli-nawilżające są bliżej siebie niż warstwy o wysokim ładunku, które oddzielają się na podstawie odpychania elektrostatycznego. Po wytworzeniu stabilnej, uwodnionej zawiesiny LMV, cząstki można zmniejszyć za pomocą różnych technik, w tym sonikacji lub wytłaczania.
C. Rozmiar zawiesiny lipidowej
i. Sonikacja
Zakłócenie zawiesin LMV za pomocą energii dźwiękowej (sonikacja) zazwyczaj wytwarza małe, jednokomórkowe pęcherzyki (SUV) o średnicach w zakresie 15-50nm. Najczęstszym oprzyrządowaniem do przygotowania sonikowanych cząstek są sonikatory do kąpieli i sondy. Sonikatory Cup-horn, choć rzadziej stosowane, z powodzeniem produkują SUV. Sonikatory z końcówką sondy zapewniają wysoką energię wejściową do zawiesiny lipidowej, ale cierpią z powodu przegrzania zawiesiny lipidowej powodującej degradację. Końcówki sonikacyjne mają również tendencję do uwalniania cząstek tytanu do zawiesiny lipidów, które muszą być usunięte przez odwirowanie przed użyciem. Z tych powodów sonikatory wannowe są najczęściej stosowanym oprzyrządowaniem do przygotowania SUV. Sonikację dyspersji LMV uzyskuje się poprzez umieszczenie probówki zawierającej zawiesinę w sonikatorze kąpielowym (lub umieszczenie końcówki sonikatora w probówce) i sonikację przez 5-10 minut powyżej Tc lipidu. Zawiesina lipidów powinna zacząć się klarować, dając lekko zamglony, przezroczysty roztwór. Zamglenie jest spowodowane rozproszeniem światła wywołanym przez resztkowe duże cząstki pozostające w zawiesinie. Cząstki te można usunąć przez odwirowanie, aby uzyskać klarowną zawiesinę SUV. Na średnią wielkość i rozkład wpływa skład i stężenie, temperatura, czas i moc sonikacji, objętość i dostrojenie sonikatora. Ponieważ prawie niemożliwe jest odtworzenie warunków sonikacji, różnice wielkości między partiami produkowanymi w różnym czasie nie są rzadkością. Ponadto, ze względu na wysoki stopień zakrzywienia tych membran, SUV są z natury niestabilne i spontanicznie łączą się, tworząc większe pęcherzyki, gdy są przechowywane poniżej ich temperatury przejścia fazowego.
Aby uzyskać więcej informacji na temat sonikacji, przeczytaj "Morrissey Lab Protocol for Preparing Phospholipid Vesicles (SUV) by Sonication."
ii. Wytłaczanie
Wytłaczanie lipidów jest techniką, w której zawiesina lipidów jest przeciskana przez filtr poliwęglanowy o określonej wielkości porów, aby uzyskać cząstki o średnicy zbliżonej do wielkości porów używanego filtra. Przed wytłaczaniem przez końcowy rozmiar porów, zawiesiny LMV są rozbijane albo przez kilka cykli zamrażania-rozmrażania, albo przez wstępne filtrowanie zawiesiny przez większy rozmiar porów (zwykle 0,2 µm-1,0 µm). Metoda ta pomaga zapobiegać zanieczyszczeniu membran i poprawia jednorodność rozkładu wielkości końcowej zawiesiny. Podobnie jak w przypadku wszystkich procedur zmniejszania rozmiaru dyspersji LMV, wytłaczanie powinno odbywać się w temperaturze powyżej Tc lipidu. Próby wytłaczania poniżej Tc będą nieskuteczne, ponieważ membrana ma tendencję do zanieczyszczania się sztywnymi membranami, które nie mogą przejść przez pory. Wytłaczanie przez filtry o porach 100 nm zazwyczaj daje duże, jednocząsteczkowe pęcherzyki (LUV) o średniej średnicy 120-140 nm. Średni rozmiar cząstek zależy również od składu lipidów i jest dość powtarzalny z partii na partię.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?