Protokół testu zabijania komórek T In Vitro
T Cell Killing Assays
Komórki T, istotny składnik ludzkiego układu odpornościowego, mają kluczowe znaczenie w zwalczaniu guzów nowotworowych lub infekcji. Obecnie opracowywane są nowe immunoterapie, które aktywują limfocyty T i zwiększają funkcję efektorową, tłumią mechanizmy hamujące lub przenoszą limfocyty T w pobliże komórek docelowych. Testy zabijania komórek T są wykorzystywane do określania siły działania nowych leków, modulacji immunologicznej nowych immunoterapii oraz do wybierania obiecujących kandydatów do badań nad lekami na modelach zwierzęcych.
Wraz z ostatnimi osiągnięciami w hodowli komórek 3D oraz organoid technologii, opracowano wiele testów zabijania komórek T w celu zbadania ich funkcjonalności i odpowiedzi na immunoterapie in vitro. Tutaj, nasz solidny i skalowalny test zabijania komórek T ocenia zdolność zabijania limfocytów naciekających nowotwór (TIL) pochodzących od pacjenta w połączeniu z immunomodulatorami do autologicznych ludzkich sferoidów nowotworowych raka jelita grubego przy użyciu 96-dołkowych płytek Millicell® Microwell. Test umożliwia wykonywanie testów specyficznych dla pacjenta dzięki zastosowaniu sferoidów nowotworowych i TIL pochodzących od pacjenta.
Czym są płytki mikrostudzienkowe Millicell®?
Obecne systemy testowania zabijania komórek T mają ograniczoną przepustowość, są często trudne w obsłudze i mogą skutkować niską powtarzalnością. Utrudnia to ich skalowanie do zastosowań o wysokiej przepustowości lub badań przesiewowych. 96-dołkowe płytki Millicell® Microwell są gotową do użycia platformą do skalowalnej i powtarzalnej hodowli organoidów.
Dołki w płytkach zawierają gotowy do użycia roztwór hydrożelu glikolu polietylenowego (PEG) i nie zawierają żadnych zewnętrznych ciał stałych macierz zewnątrzkomórkowa (ECM) jest wymagana. Roztwór PEG w studzienkach jest biokompatybilny i umożliwia skuteczną agregację komórek macierzystych. Jest również oparty na wodzie, co sprzyja obrazowaniu bez dyfrakcji.
Ponieważ sferoidy lub organoidy utworzone w studzienkach znajdują się w jednej płaszczyźnie ogniskowej, płytki Millicell® Microwell są idealne do automatyzacji przepływu pracy i obrazowania. Aby przeciwdziałać utracie mikrotkanek, płytki Millicell® Microwell są również wyposażone w port wymiany pożywki ułatwiający wymianę pożywki bez naruszania mikrotkanek. Ta ustandaryzowana i jednorodna hodowla organoidów jest idealna do łatwego wdrażania zastosowań badawczych w zakresie hodowli komórek 3D.
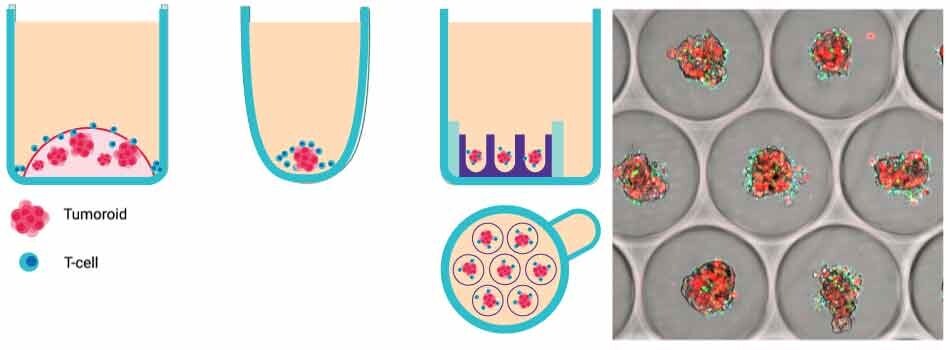
Rysunek 1. A. Przegląd testów zabijania komórek T na płytkach mikrostudzienkowych Millicell®. Schematyczne przedstawienie systemów do badania zabijania komórek T in vitro. Od lewej do prawej: zewnętrzne osadzanie ECM (np. Matrigel), powierzchnia nieadherentna, płytka Microwell Millicell®. B. Obraz Brightfield sferoidów nowotworowych utworzonych przy użyciu 96-dołkowych płytek Millicell® Microwell.
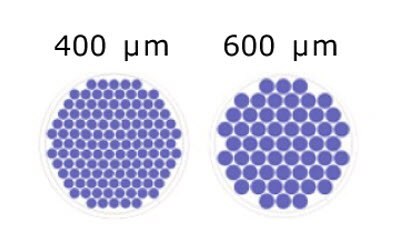
Rysunek 2.Schematyczne przedstawienie liczby mikrostudzienek/dołek w oparciu o rozmiar mikrostudzienek dla 96-dołkowych płytek Millicell® Microwell.
Protokół testu zabijania komórek T
Zastosowując ten protokół, w pojedynczym dołku utworzono do sferoidów nowotworowych i współhodowano je z TIL. Potencjał zabijania komórek T wykorzystał półautomatyczną analizę obrazu i został przeprowadzony in situ.
- Wprowadź linię komórkową tworzącą sferoidy ludzkiego raka jelita grubego do mikrowgłębień za pomocą O-ringu w 96-dołkowej płytce Millicell® Microwell 600μm.
- Dodaj pożywkę hodowlaną przez port wymiany pożywki. Uwaga: jeśli wymagany jest ECM, można go rozcieńczyć w pożywce i dodać w tym kroku. Komórki zagęszczą się w hodowli przypominającej zawiesinę.
- Pozwól sferoidom nowotworowym rosnąć i w pełni się rozwinąć. Wymień pożywkę przez port wymiany pożywki po 4-6 dniach.
- Dodaj TILs, aż do osiągnięcia pożądanego stosunku efektora do celu (E: T). Uwaga: test ten został przeprowadzony w obecności lub nieobecności immunomodulatorów IL2, CD3 (IL2 + -CD3/CD28) i PD1 (IL2 + -CD3/CD28 + -PD1/CTLA4).
- Monitoruj wzrost w czasie za pomocą trackerów komórek1. W tym teście komórki nowotworowe, limfocyty T i martwe komórki były znakowane odpowiednio znacznikiem dalekiej czerwieni (niebieski, CellTrace™ Far Red Cell Proliferation Kit; Molecular Probes), CFSE (zielony) i jodkiem propidyny (czerwony).
Barwienie komórek T:
- Zawiesić komórki w roztworze barwiącym CFSE (1:200 w buforze testowym, a następnie rozcieńczenie 1:2 w ciepłym PBS) i inkubować w 37˚C przez 20 minut.
- Dodaj taką samą objętość pożywki z 10% FBS i inkubuj przez 10 minut.
- Wiruj z prędkością 200xg przez 5 minut.
- Zawiesić ponownie komórki w pożywce w pożądanym stężeniu; np. 10M komórek/ml.
Dla barwienia organoidów:
- Zawiesić komórki w 1ml ciepłego PBS ze śladem (1:1000) i inkubować w 37˚C przez 20 minut.
- Dodaj taką samą ilość pożywki (DMEM + 10% FBS) i inkubuj przez 5 minut w temperaturze 37˚C.
- Wiruj z prędkością 200xg przez 5 minut.
- Zawiesić komórki w 1 ml pożywki.
- Dodać barwnik jodku propidium w celu oceny zabijania komórek T. Rozcieńczenie jodku propidium zależy od zaleceń dostawcy.
- Przeprowadź półautomatyczną analizę obrazu w celu ilościowego określenia śmierci komórek, wielkości guza i migracji TIL.
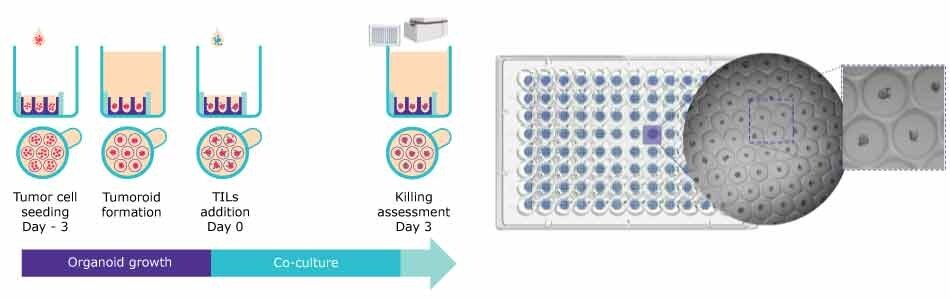
Rysunek 3. Protokół zabijania komórek T przy użyciu 96-dołkowych płytek Millicell® Microwell. A. Przebieg testu dla wzrostu i tworzenia organoidów oraz ocena współhodowli z TIL. B. Reprezentatywny obraz Brightfield sferoidów ludzkiego guza jelita grubego.
Millicell® Microwell T Cell Killing Results
Płytki Millicell® Microwell pozwoliły na zwiększenie kontaktu komórka-komórka i kontrolowaną współhodowlę sferoidów nowotworowych w bezpośrednim kontakcie z limfocytami T, podobnie jak ma to miejsce in vivo. Ponieważ wiele jednorodnych sferoidów nowotworowych można ocenić w jednym dołku, istnieje znaczny wzrost liczby punktów danych na dołek.
Nasz test pokazuje, że wybrana próbka pacjenta miała autonomiczną aktywację komórek T i zwiększoną odpowiedź cytotoksyczną w obecności inhibitorów immunologicznego punktu kontrolnego. W 3. dniu po utworzeniu sferoidu całkowita powierzchnia sferoidu guza zmniejszyła się w obecności immunomodulatorów (Rysunek 4). Wskazuje to, że dodanie immunomodulatorów prowadziło do śmierci i kurczenia się guza. Wyższy stosunek efektora do celu skutkuje skuteczniejszym zabijaniem. Zostało to zaobserwowane przez zwiększony sygnał jodku propidium poprzez obrazowanie fluorescencyjne.

Rysunek 4.Sferoidy guza jelita grubego pochodzące od pacjenta i ocena współhodowli autologicznych TIL. A. Obrazy mikroskopowe Brightfield komórek nowotworowych (niebieski), z komórkami T w stosunku 10:1 E:T (zielony) i martwymi komórkami (czerwony). Pasek skali 500 μm. B. Kwantyfikacja barwienia jodkiem propidyny w dniu 3; C. Kwantyfikacja obszaru sferoidu guza w dniu 3.
Test ten został zweryfikowany przy użyciu mysiego modelu transgenicznego Pmel-1. Sferoidy guza czerniaka zostały zniszczone w obecności komórek T, ale były w stanie rosnąć stabilnie przy braku komórek T. Jak zaobserwowano w teście zabijania komórek T in vitro, wysoki stosunek E:T prowadzi do bardziej skutecznego zabijania guza.

Rysunek 5.Test zabijania komórek T w mysim modelu Pmel-1. A. Obrazowanie Brightfield sferoidów guza czerniaka B16-F10 współhodowanych z celowanymi komórkami T w stosunku 10:1 E:T. Pasek skali 500 μm. B. Kwantyfikacja intensywności jodku propidium w dniu 2.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?