Protokół testu inwazji sferoidów BME 3D Cultrex®
I. Opis produktu
96-dołkowy test 3D Spheroid BME Cell Invasion Assay oferuje standaryzowany, trójwymiarowy format o wysokiej zawartości do ilościowego określania stopnia, w jakim komórki inwazyjne przenikają przez barierę składającą się ze składników błony podstawnej in vitro w odpowiedzi na chemoatraktanty i/lub związki hamujące, co ma fundamentalne znaczenie dla angiogenezy1.sup>1, rozwoju embrionalnego2, odpowiedzi immunologicznej3 i przerzutów komórek nowotworowych4. Błony podstawne to ciągłe arkusze wyspecjalizowanej macierzy zewnątrzkomórkowej, które tworzą interfejs między komórkami śródbłonka, nabłonka, mięśni lub neuronów a sąsiadującym z nimi zrębem. Nie tylko wspierają komórki i warstwy komórek, ale także odgrywają istotną rolę w organizacji tkanek, wpływając na adhezję, migrację, proliferację i różnicowanie komórek. Błony podstawne są degradowane i regenerowane podczas rozwoju i naprawy ran, a także stanowią główną barierę dla inwazji przerzutowych komórek nowotworowych. Obecne metody oceny inwazji komórek przez barierę błony podstawnej najczęściej wykorzystują podejście komory Boydena, takie jak Cultrex® BME Cell Invasion Assays. Metoda ta zapewnia szybkie, łatwe i ilościowe podejście. Jednak bardzo trudno jest wizualizować inwazję mikroskopowo, a test rozpoczyna się od zawiesiny pojedynczych komórek, co może negować wczesne etapy procesu przerzutowego, takie jak początkowe przejście nabłonkowe do mezenchymalnego (EMT).
Potrzeba bardziej kompletnych i fizjologicznie przewidywalnych modeli inwazji nowotworów doprowadziła do opracowania 96-dołkowego testu 3D Spheroid BME Cell Invasion Assay. Istnieje coraz więcej dowodów na to, że agregaty komórek nowotworowych lub sferoidy są bardziej reprezentatywne dla guzów in vivo i wykazują kilka cech fizjologicznych, w tym podobną morfologię, tworzenie wiązań komórka-komórka, zmniejszone tempo proliferacji, zwiększoną przeżywalność komórek, uśpienie guza i niedotleniony rdzeń5-8. Zastosowanie tego modelu do testu inwazji w kulturze 3D zapewnia bardziej fizjologiczne podejście do oceny inwazji guza i oferuje element wizualny, który można określić ilościowo za pomocą analizy obrazu.
96-dołkowy test inwazji komórek 3D Spheroid BME wykorzystuje 96-dołkową płytkę do tworzenia sferoidów zakwalifikowaną do kultury 3D wraz ze specjalistycznym ECM do tworzenia sferoidów w celu napędzania agregacji i/lub tworzenia sferoidów komórek. Po zakończeniu formowania sferoidu jest on osadzany w matrycy inwazyjnej złożonej z białek błony podstawnej. Matryca ta tworzy hydrożelową sieć, po której mogą przemieszczać się komórki inwazyjne. W tym momencie do systemu można zastosować czynniki modulujące inwazję, aby ocenić wpływ na odpowiedź komórek. Inwazja komórek jest wizualizowana mikroskopowo i może być określona ilościowo za pomocą oprogramowania do analizy obrazu.
II. Składniki |
|---|
III. Odczynniki i wyposażenie wymagane, ale niedostarczane
- Wyposażenie
- Kaptur o przepływie laminarnym lub pomieszczenie czyste
- 37 °C CO2 inkubator
- Wirówka o niskiej prędkości obrotowej wiadra 4°C i probówki do zbierania komórek
- Hemocytometr lub inny środek do liczenia komórek
- Przechowywanie w temperaturze 80 °C
- Wiadro z lodem
- Standardowy mikroskop świetlny (lub odwrócony)
- Pipety i pomoc do pipetowania
- Mikroskop jasnego pola z 4-krotnym obiektywem i kamerą cyfrową
- Odczynniki
- Linie komórkowe będące przedmiotem zainteresowania
- Bufor do zbierania komórek; EDTA, trypsyna lub inny bufor do odłączania komórek
- Podłoże do hodowli tkankowej
- Środki farmakologiczne do dodania do podłoża hodowlanego, jeśli to konieczne
- Kolby do hodowli ziarnistej, poddane obróbce hodowli tkankowej, 25 cm2 (Nr produktu. C6231) lub 75 cm2 (Nr produktu C7106)
- Rurki do wirówek
- Pipety serologiczne
- Gloves

Rysunek 1.Kroki składające się na 96-dołkowy test inwazji komórek BME 3D Spheroid
IV. Środki ostrożności i ograniczenia
- Wyłącznie do użytku badawczego. Nie do użytku w procedurach diagnostycznych.
- Właściwości fizyczne, chemiczne i toksykologiczne tych produktów mogą nie być jeszcze w pełni zbadane; dlatego zalecamy stosowanie rękawic, fartuchów laboratoryjnych i ochrony oczu podczas korzystania z tych odczynników chemicznych.
- CULTREX® 3D Culture 96-Well BME Invasion Assay zawiera odczynniki, które mogą być szkodliwe w przypadku połknięcia lub kontaktu ze skórą lub oczami. W przypadku kontaktu z oczami należy natychmiast przemyć je dużą ilością wody i zasięgnąć porady lekarza.
V. Instrukcja przygotowania
- 10X Spheroid Formation ECM
10X Spheroid Formation ECM należy rozmrozić na lodzie w temperaturze 4 ⁰C i rozcieńczyć Tissue Culture Growth Medium schłodzonym do temperatury 4 ⁰C; pipetować w górę i w dół pipetą serologiczną w celu wymieszania. Komórki są ponownie zawieszane w 1X Spheroid Formation ECM, a 50 µL zawiesiny komórek jest dodawane do każdej studzienki 96-dołkowej płytki do tworzenia sferoidów 3D Culture Qualified.
Tabela 1 dla zalecanych schematów rozcieńczania.
- Matryca inwazyjna
Matrycę inwazyjną należy rozmrozić na lodzie w temperaturze 4 ⁰C i delikatnie odwrócić, aby uzyskać jednorodny roztwór. Jeśli w matrycy Invasion Matrix widoczne są pęcherzyki powietrza, należy odwirować ją z prędkością 300 x g przez 5 minut w temperaturze 4 ⁰C w obrotowym rotorze kubełkowym. Dodać 50 μL nierozcieńczonej matrycy inwazyjnej do każdej studzienki inwazyjnej schłodzonej 96-dołkowej płytki do formowania sferoidów 3D Culture Qualified.
- Podłoże do hodowli tkankowej ze związkami modulującymi inwazję
Dodaj 2-krotne stężenie związków modulujących inwazję w podłożu do hodowli tkankowej, aby skompensować zmiany całkowitej objętości spowodowane osadzeniem sferoidy w matrycy inwazyjnej. Pożywka do hodowli tkankowych musi mieć temperaturę 37 ⁰C, gdy jest dodawana do zżelowanej matrycy inwazyjnej, aby zachować właściwości żelu.
VI. Przechowywanie i stabilność
Produkt jest stabilny przez co najmniej 3 miesiące od daty wysyłki, jeśli jest przechowywany w temperaturze -20 ⁰C w ręcznie rozmrażanej zamrażarce. Aby uzyskać optymalną stabilność, należy przechowywać w temperaturze -80 ⁰C. Unikać cykli zamrażania-rozmrażania.
VII. Protokół testu
Procedury te powinny być wykonywane w okapie biologicznym z wykorzystaniem techniki aseptycznej, aby zapobiec zanieczyszczeniu.
A. Zbiór komórek
Hoduj komórki zgodnie z zaleceniami producenta. Poniższa procedura jest sugerowana i może wymagać optymalizacji w celu dostosowania do badanego typu komórek.
- Komórki muszą być zdrowe i proliferujące przed użyciem w teście. Komórki powinny być pasażowane 2 lub 3 razy i oceniane pod kątem żywotności komórek za pomocą błękitu trypanu lub równoważnego testu. Nie należy rozpoczynać testu, dopóki żywotność komórek nie przekroczy 90%.
- Każda studzienka wymaga około 2 000 - 5 000 komórek, a 25 i 75 cm2 kolby dają odpowiednio co najmniej 1 x 106 i 3 x 106 komórek. Zaplanuj odpowiednio.
- Przed zbiorem, wizualnie sprawdź komórki i zapisz stan zdrowia komórek, względną liczbę i morfologię.
- Płucz komórki dwa razy sterylnym PBS lub HBSS. Użyj 5 ml na płukanie dla kolby 25 cm2 i 10 ml na płukanie dla kolby 75 cm2
- Zbierz komórki. Do kolby o pojemności 25 cm2 lub 75 cm2 dodać odpowiednio 1 mL lub 2 mL buforu do zbioru komórek (patrz Materiały wymagane, ale niedostarczane) i inkubować w temperaturze 37 ⁰C przez 5 do 15 minut, aż komórki oddzielą się od dna kolby.
- Przenieść komórki do stożkowej probówki o pojemności 15 ml i dodać 5 ml pożywki do hodowli komórkowej.
- Wirować komórki z prędkością 200 x g przez 3 minuty w celu osadu komórek, usunąć pożywkę i ponownie zawiesić komórki w 2 ml pożywki do hodowli komórkowej. Komórki mogą wymagać delikatnego pipetowania w górę i w dół za pomocą pipety serologicznej, aby ponownie zawiesić komórki i rozbić agregaty komórek. Przed zliczeniem komórek sprawdź wzrokowo, czy tworzy się zawiesina pojedynczych komórek, bez agregatów.
- Zlicz komórki i oceń żywotność komórek za pomocą wykluczenia błękitu trypanu lub równoważnego testu. Nie należy rozpoczynać testu, jeśli żywotność komórek jest mniejsza niż 90%.
- Rozcieńczyć do 1 x 106 komórek na ml w pożywce do hodowli komórkowej.
B. 96-dołkowy test inwazji 3D sferoidalnych komórek BME
- Przygotowanie testu - przed dniem 0
- Ustal parametry testu i odpowiednie kontrole. Odpowiednie kontrole obejmują próbki z i bez czynników modulujących inwazję, a także próbki z i bez matrycy inwazyjnej.
- Określ optymalną gęstość siewu dla każdej używanej linii komórkowej. Ogólnie rzecz biorąc, 3000 komórek na studzienkę jest dobrym punktem wyjścia. Optymalną gęstość wysiewu można ocenić, analizując wielkość formowania sferoidy przy użyciu protokołu formowania sferoidy (VII.B.2.).).
- Hoduj komórki zgodnie z zaleceniami producenta; komórki adherentne powinny być hodowane do konfluencji nie większej niż 80%.
- Rozmrażaj 10X Spheroid Formation ECM na lodzie przez noc w lodówce o temperaturze 4 ⁰C.
- Formowanie sferoidów - dzień 0
- Zbierz i policz komórki, zgodnie z zaleceniami w sekcji VII. A.
- Przygotuj zawiesinę pojedynczych komórek w 1X Spheroid Formation ECM. Patrz sekcja V.1. w celu przygotowania odczynników.
- Dozuj 50 μL zawiesiny pojedynczych komórek w 1X Spheroid Formation ECM na studzienkę płytki 3D Culture Qualified 96 Well Spheroid Formation Plate. Zachowaj niewykorzystane dołki do kolejnych eksperymentów, stosując w razie potrzeby uszczelki paskowe dołączone do każdej płytki.
- Wiruj z prędkością 200 x g przez 3 minuty w temperaturze pokojowej w wirniku z wahadłowym kubełkiem.
- Inkubować w temperaturze 37 ⁰C w inkubatorze do hodowli tkankowej przez 72 godziny w celu promowania tworzenia sferoidów.
- 3D Culture Cell Invasion - Day 3
- Umieść płytkę 3D Culture Qualified 96 Well Spheroid Formation Plate na lodzie na 15 minut w celu schłodzenia studzienek.
- Pracując na lodzie, dodaj 50 μL matrycy inwazyjnej na studzienkę płytki 3D Culture Qualified 96 Well Spheroid Formation Plate; patrz sekcja V.2. w celu przygotowania odczynników.
- Wiruj płytki 300 x g w rotorze wahadłowym, aby wyeliminować pęcherzyki powietrza.Przygotowanie odczynników.
- Wirować płytki z prędkością 300 x g w temperaturze 4 ⁰C przez 5 minut w wirniku kubełkowym, aby wyeliminować pęcherzyki powietrza i umieścić sferoidy w matrycy inwazyjnej w kierunku środka dołka.
Uwaga: wirowanie z dużą prędkością i/lub przez dłuższy czas może niekorzystnie wpłynąć na późniejszą inwazję sferoidów. - Płytkę przenieść do inkubatora hodowli tkankowej ustawionego na 37 ⁰C na jedną godzinę, aby promować tworzenie żelu matrycy inwazyjnej.
- Po jednej godzinie dodać 100 μL ciepłego (37 ⁰C) podłoża do hodowli komórkowej zawierającego chemoatraktanty i związki modulujące inwazję, jeśli dotyczy. Patrz sekcja V.3 dotycząca przygotowania odczynników.
- Inkubuj płytkę w temperaturze 37 ⁰C w inkubatorze do hodowli tkankowych przez 3 do 6 dni i fotografuj sferoidy w każdej studzience co 24 godziny za pomocą obiektywu 4X. Dostosuj oświetlenie i ostrość, aby zapewnić jak największy kontrast między strukturą 3D a tłem. Zastosowanie mikroskopii fluorescencyjnej w przypadku komórek wykazujących ekspresję białka fluorescencyjnego lub posiadających etykietę fluorescencyjną może również poprawić kontrast i późniejszą analizę. Zanieczyszczenia mogą przenieść się na dno 96-dołkowej płytki podczas przenoszenia; przetarcie dna dołków papierem soczewkowym przed fotografowaniem może poprawić przejrzystość. W razie potrzeby test można przeprowadzić dłużej niż 6 dni; punktem końcowym jest zwykle moment, w którym rozmiar struktury zaczyna przekraczać pole analizy lub komórki zaczynają wygasać.
- Analizuj obrazy za pomocą oprogramowania do analizy obrazu, aby zmierzyć zmiany w obszarze struktur inwazyjnych w celu określenia zakresu inwazji komórek BME w hodowli 3D dla każdej próbki.
- Analiza obrazu
Uwaga: Obrazy mogą być analizowane przy użyciu bezpłatnego oprogramowania, takiego jak ImageJ (http://rsb.info.nih.gov/ij/); patrz poniżej. Inne oprogramowanie do analizy obrazu może być skonfigurowane do wykonywania tych samych pomiarów; należy skonsultować się z dostawcą oprogramowania w sprawie możliwości i instrukcji.- Zrób zdjęcie obrazu o znanym rozmiarze (np. 1 mm) za pomocą obiektywu 4X i zmierz piksele w ImageJ.
- Otwórz obraz. Przejdź do Plik/Otwórz i wybierz obraz.
- Wybierz narzędzie linii.
- Narysuj linię o długości obiektu.
- Przejdź do Analyze/Measure i zapisz liczbę pikseli.
- Oblicz liczbę pikseli w każdym mm (np. 600 pikseli/mm). Zapisz wynik ------- pikseli/mm
- Ustaw skalę; należy to zrobić przy każdym otwarciu ImageJ.
- Przejdź do Analyze/Set Scale.
- Dla "Distance in pixels" wprowadź wartość z VII.B.4.v. (powyżej).
- Dla "Know distance" wprowadź "1,000".
- Dla "Unit of Length" wprowadź "um".
- Zaznacz "Global" i wybierz "OK".
- Analizuj obraz sferoidy.
- Otwórz obraz. Przejdź do Plik/Otwórz i wybierz obraz.
- Konwertuj na obraz 8-bitowy: Przejdź do Image/Type/8 bit (zaznacz).
- Adjust image threshold. Przejdź do Image/Adjust/Threshold (zaznacz). Program rozróżni ciemne i jasne piksele, a próg można dostosować na histogramie za pomocą przesuwanej skali. Podobne ustawienia będą działać dla zdjęć wykonanych w tych samych warunkach. Obszary ciemnych pikseli zostaną pokryte kolorem czerwonym. Dostosuj próg tak, aby nałożony został tylko obraz sferoidy.
- Wybierz sferoidę. Wybierz narzędzie okręgu i otocz nim obraz. Spowoduje to wyeliminowanie wszelkich ciemnych pikseli poza sferoidą z pomiaru.
- Przejdź do Analyze/Measure. Spowoduje to zmierzenie obszaru struktury sferoidalnej (μM2) w tabeli. W jednej tabeli można dokonać wielu pomiarów. Zapisz tabelę.
- Konwertuj tabelę do arkusza programu Excel. Otwórz w programie Excel i "Zapisz jako" plik .xls lub .xlsx.
- Zrób zdjęcie obrazu o znanym rozmiarze (np. 1 mm) za pomocą obiektywu 4X i zmierz piksele w ImageJ.

Rysunek 2.Proces analizy inwazji 3D A) Przechwyć obraz i przekonwertuj na 8-bitowy; B) Ustaw próg, aby uchwycić całą strukturę; C) Wybierz strukturę, aby obliczyć całkowity obszar.
VIII. Interpretacja danych
1. Cultrex® 3D Culture 96-Well BME Invasion Assay zapewnia morfologiczną i ilościową analizę inwazji komórek. Inwazyjne komórki wystają ze sferoidy do otaczającej matrycy w postaci wrzecionowatych projekcji; podczas gdy nie ma projekcji w przypadku braku matrycy inwazyjnej (rys. 3). Powoduje to duże zmiany powierzchni, które występują w stosunkowo krótkim czasie w przypadku inwazyjnych linii komórkowych, które nie występują w przypadku nieinwazyjnych linii komórkowych (Rysunek 4). Te zmiany powierzchni mogą być mierzone i wykorzystywane do porównywania względnej inwazyjności różnych linii komórkowych lub linii komórkowych poddanych manipulacji genetycznej.

Rysunek 3.Morfologia inwazji komórek 3D w okresie czterech dni. Komórki nieinwazyjne (MCF-7) pozostają jako agregaty komórek i nie wnikają do otaczającej macierzy inwazyjnej; natomiast komórki inwazyjne (MDA-MB-231) wnikają do otaczającej macierzy inwazyjnej w postaci wrzecionowatych wypustek.
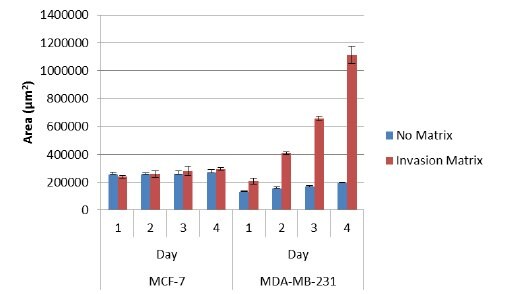
Rysunek 4.Analiza ilościowa powierzchni dla nieinwazyjnych (MCF-7) i inwazyjnych (MDA-MB-231) linii komórkowych w okresie czterech dni.
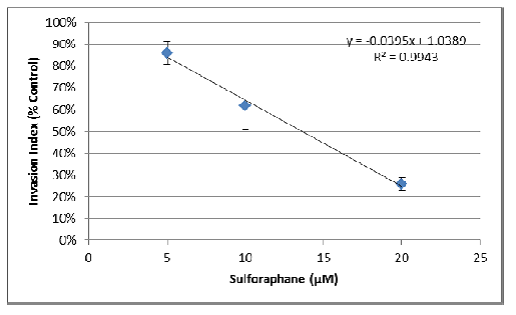
2. Zmiany powierzchni mogą być również wykorzystane do oceny wpływu związków farmakologicznych na inwazję komórek 3D. Po ustaleniu optymalnych warunków testu można to ocenić jako test punktu końcowego. Poniższy test przeprowadzono przy użyciu komórek MDA-MB-231 traktowanych różnymi stężeniami inhibitora Sulforaphane.
a. Najpierw obliczono obszary dla każdego warunku, a wartości te wykorzystano do wygenerowania średniej i odchyleń standardowych:
a.

b. Następnie obszar dla sferoidy bez macierzy inwazji został użyty jako wartość tła i odjęty od średniej dla każdego warunku:

c. Na koniec, uzyskane obszary podzielono przez obszar uzyskany dla kontroli bez inhibitora, uzyskując wskaźnik inwazji jako procent kontroli:

d. Wykorzystując liniową część krzywej hamowania, IC50 można obliczyć, określając x, gdzie y = 0,5:
- Na podstawie równania liniowego, x = (y - 1,0389) / -0,0395.
- Zatem IC50 = (0,5 - 1,0389) / -0,0395 = 13,6 μM Sulforafanu
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?