Protokoły hodowli mezenchymalnych komórek macierzystych
Izolacja mezenchymalnych komórek macierzystych
Ekspansja ludzkich mezenchymalnych komórek macierzystych
Różnicowanie ludzkich mezenchymalnych komórek macierzystych
Często zadawane pytania
Mezenchymalne komórki macierzyste (MSC) mają zdolność do wieloliniowego różnicowania, dając początek różnym fenotypom mezenchymalnym, takim jak osteoblasty (kości), adipocyty (tłuszcz) i chondrocyty (chrząstka). Terapia komórkami macierzystymi niesie ze sobą ogromną obietnicę dostarczenia następnej generacji przełomowych rozwiązań medycznych. Pod tym względem multipotencjalne komórki progenitorowe, takie jak hMSC, cieszą się dużym zainteresowaniem klinicznym ze względu na ich zdolność do różnicowania się w różne typy komórek i właściwości immunoregulacyjne. Łącznie cechy te umożliwiają allogeniczne wykorzystanie hMSCs, a tym samym czynią je atrakcyjnym celem dla komercyjnego rozwoju terapeutycznego. Poniżej znajdują się protokoły krok po kroku stosowane do izolacji, ekspansji i różnicowania MSC w kulturach komórek macierzystych.
Browse all Mesenchymal Stem Cell Products
Methods
Izolacja mezenchymalnych komórek macierzystych
Mezenchymalne komórki macierzyste zostały wyizolowane z różnych tkanek, w tym ludzkiego szpiku kostnego, tkanki tłuszczowej, pępowiny i miazgi zębowej. Poniżej znajduje się prosty ogólny protokół, który może być stosowany do pozyskiwania MSC z różnych źródeł tkankowych.
Uwaga: Populacje MSC będą się różnić w zależności od dawcy i mogą wymagać dalszej optymalizacji.
- Uzyskaj świeże aspiraty tkankowe, które są pobierane w warunkach aseptycznych.
- Przefiltruj zawiesinę komórek przez 70-milimetrową siatkę filtracyjną (CLS431751), aby usunąć wszelkie grudki komórek.
- Wiruj komórki z prędkością 500g przez 5 minut w wirówce stołowej.
- Zawiesić komórki i określić wydajność i żywotność komórek poprzez wykluczenie błękitu Trypana (T8154)
- Hodować komórki w naczyniach hodowlanych T75 w 10 ml kompletnej pożywki MSC (SCM015 lub SCM045) w gęstości 25 × 106 komórek/mL. Inkubuj płytki w temperaturze 37°C z 5% CO2 w nawilżanej komorze bez zakłócania ich pracy.
- Po 3 godzinach usunąć nieprzylegające komórki, które gromadzą się na powierzchni płytki, zmieniając pożywkę i zastępując ją 10 ml świeżej kompletnej pożywki.
- Po dodatkowych 8 godzinach hodowli zastąpić pożywkę 10 ml świeżej kompletnej pożywki. Następnie powtarzaj ten krok co 8 godzin przez maksymalnie 72 godziny początkowej hodowli.
- Komórki mogą być zamrożone w pożywce wzrostowej MSC plus 10% DMSO (D2650) w gęstości 2X106 komórek/fiolkę.
Ekspansja ludzkich mezenchymalnych komórek macierzystych
A. Przygotowanie płytek powlekanych
Płytki plastikowe lub szklane do hodowli tkankowych powinny być pokryte 0,1% żelatyną w następujący sposób:
- Dodaj wystarczającą ilość 0,1% roztworu żelatyny (ES-006-B), aby pokryć całą powierzchnię płytki. Użyj objętości 10 ml dla płytek 10 cm i kolb T75. Inkubować przez co najmniej 30 minut w temperaturze pokojowej.
- Tuż przed użyciem odessać roztwór żelatyny z pokrytej płytki lub kolby.
B. Rozmrażanie mezenchymalnych komórek macierzystych
- Nie rozmrażać komórek, dopóki nie będzie dostępna zalecana pożywka i odpowiednio pokryte 0,1% żelatyną plastikowe i/lub szklane naczynia.
- Wyjmij fiolkę z ludzkimi mezenchymalnymi komórkami macierzystymi (SCC034, SCC038) z ciekłego azotu i inkubuj w łaźni wodnej o temperaturze 37°C. Dokładnie monitorować, aż komórki zostaną całkowicie rozmrożone. Maksymalna żywotność komórek zależy od szybkiego i całkowitego rozmrożenia zamrożonych komórek.
WAŻNE: Nie worteksuj komórek.
- Jak tylko komórki zostaną całkowicie rozmrożone, zdezynfekuj zewnętrzną część fiolki 70% etanolem. Natychmiast przejdź do następnego kroku.
- W kapturze z przepływem laminarnym użyj pipety o pojemności 1 lub 2 ml, aby przenieść komórki do sterylnej stożkowej probówki o pojemności 15 ml. Uważaj, aby nie wprowadzić żadnych pęcherzyków podczas procesu transferu.
- Używając pipety o pojemności 10 ml, powoli dodaj kroplami 9 ml pożywki do ekspansji mezenchymalnych komórek macierzystych (SCM015. lub SCM045) lub odpowiednią alternatywę, wstępnie ogrzaną do temperatury 37 °C, do probówki stożkowej o pojemności 15 ml.
WAŻNE: Nie dodawaj całej objętości pożywki naraz do komórek. Może to spowodować zmniejszenie żywotności komórek z powodu szoku osmotycznego.
- Delikatnie wymieszaj zawiesinę komórek, powoli pipetując dwukrotnie w górę i w dół. Należy uważać, aby nie wprowadzić żadnych pęcherzyków powietrza.
WAŻNE: Nie worteksować komórek.
- Wirować probówkę z prędkością 300 x g przez 2-3 minuty w celu osuszenia komórek.
- Zlać jak najwięcej supernatantu. Kroki 5-8 są niezbędne do usunięcia pozostałości środka kriokonserwującego (DMSO).
- Zawiesić komórki w całkowitej objętości 10 ml pożywki do ekspansji mezenchymalnych komórek macierzystych (SCM015 lub SCM045) lub odpowiedniej alternatywy, wstępnie ogrzanej do temperatury 37 °C, zawierającej świeżo dodane 8 ng/ml FGF-2 (F0291).
- Nałożyć zawiesinę komórek na 10-centymetrową płytkę do hodowli tkankowej lub kolbę do hodowli tkankowej T75.
WAŻNE: Gęstość wysiewu powinna wynosić 5,000-6,000 komórek/cm2
- Podtrzymuj komórki w temperaturze 37 °C w nawilżonym inkubatorze z równowagą 5% CO2.
- Następnego dnia wymienić pożywkę na świeżą pożywkę do ekspansji mezenchymalnych komórek macierzystych (ogrzaną do temperatury 37°C) zawierającą 8 ng/ml FGF-2*. Następnie wymieniać na świeżą pożywkę zawierającą FGF-2 co dwa do trzech dni.
- Kiedy komórki osiągną około 80% konfluencji, można je zdysocjować za pomocą trypsyny-EDTA (SM-2003-C) i pasażować dalej lub zamrozić do późniejszego wykorzystania.
C. Ekspansja mezenchymalnych komórek macierzystych
- Podkulturuj komórki po osiągnięciu około 80% konfluencji i aktywnej proliferacji.
WAŻNE: Podkulturuj komórki przed osiągnięciem 100% konfluencji.
- Ostrożnie usuń pożywkę z 10-centymetrowej płytki do hodowli tkankowej zawierającej konfluentną warstwę ludzkich mezenchymalnych komórek macierzystych. Nałóż 3-5 ml roztworu Trypsin-EDTA (SM-2003-C) i inkubuj w inkubatorze 37°C przez 3-5 minut.
- Sprawdź płytkę i upewnij się, że komórki zostały całkowicie odłączone, delikatnie stukając dłonią w bok płytki.
- Dodaj 5 ml Mesenchymal Stem Cell Expansion Medium (SCM015 lub SCM045) do płytki.
- Delikatnie obróć płytkę, aby wymieszać zawiesinę komórek. Przenieś zdysocjowane komórki do stożkowej probówki o pojemności 15 ml.
- Wiruj probówkę z prędkością 300 x g przez 3-5 minut w celu osuszenia komórek.
- Odrzucić supernatant
- Nałożyć 2 ml pożywki do ekspansji mezenchymalnych komórek macierzystych (ogrzanej do temperatury 37°C) zawierającej 8 ng/ml FGF-2 do probówki stożkowej i dokładnie zawiesić komórki.
WAŻNE: Nie worteksować komórek.
- Zlicz liczbę komórek za pomocą hemocytometru.
- Umieść komórki w gęstości 5,000-6,000 komórek na cm2 w odpowiednich kolbach, płytkach lub studzienkach w pożywce do ekspansji mezenchymalnych komórek macierzystych zawierającej 8 ng/ml FGF-2.
- Komórki mogą być zamrożone w pożywce wzrostowej MSC plus 10% DMSO (D2650) w gęstości 2X106 komórek/fiolkę.
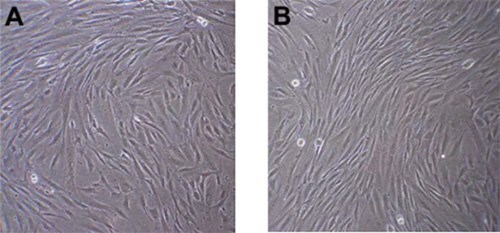
Rysunek 1.Obrazy kontrastu fazowego ludzkich mezenchymalnych komórek macierzystych jeden (A) i dwa (B) dni po rozmrożeniu. Zwróć uwagę na wrzecionowatą morfologię przypominającą fibroblasty. Tuż przed pasażowaniem komórki powinny być w ~80% konfluentne.

Rysunek 2. Barwienie ICC hodowanych ludzkich mezenchymalnych komórek macierzystych pochodzących ze szpiku kostnego za pomocą przeciwciał dostarczonych w zestawie do charakteryzacji ludzkich mezenchymalnych komórek macierzystych. Ludzkie mezenchymalne komórki macierzyste wykazują ekspresję H-CAM (CD44) (A, CBL154; rozcieńczenie 1/500), THY-1 (CD90) (B, CBL415: rozcieńczenie 1/500) i STRO-1 (C, MAB4315: rozcieńczenie 1/500). Jądra komórek uwidoczniono za pomocą DAPI (niebieski). Ekspresja markerów hematopoetycznych komórek macierzystych, CD19 (MAB1794) i CD14 (MAB1219) oraz markera śródbłonka, CD146 (MAB16985) nie była obserwowana w ludzkich mezenchymalnych komórkach macierzystych (dane nie pokazane).
Różnicowanie ludzkich mezenchymalnych komórek macierzystych
Osteogeneza mezenchymalnych komórek macierzystych
Używając ludzkiej fibronektyny, 20 µg/mL (FC010) lub 0.1% żelatyny (ES-006-B) pokrytej 48-dołkową płytką do hodowli tkankowej, wysiej 20 tys. komórek/dołek w 0.5 ml normalnej pożywki do wzrostu MSC (SCM015 lub SCM045). Po całonocnej inkubacji wymień podłoże hodowlane na OsteoMAX-XF™ Differentiation Media (SCM121). Wymieniaj pożywkę co 2-3 dni przez łącznie 14-21 dni. Osteocyty wybarwione czerwienią alizarynową (TMS-008) zaczną się formować około 7 dnia z maksymalną ekspresją około 14 dnia.
Adipogeneza mezenchymalnych komórek macierzystych
Używając 24-dołkowej płytki do hodowli tkankowej, wysiej 60 tys. komórek/dołek w 1 ml normalnej pożywki wzrostowej MSC (SCM015 lub SCM045). Po całonocnej inkubacji zastąpić podłoże hodowlane pożywką AdipoMAX™ Differentiation Media (SCM122). Wymieniaj pożywkę co 2-3 dni przez łącznie 14-21 dni. Adipocyty wybarwione barwnikiem Oil-Red-O (O1391) zaczną się formować około 14 dnia z maksymalną ekspresją około 21 dnia.
Chondrogeneza mezenchymalnych komórek macierzystych
Mezenchymalne komórki macierzyste mogą być indukowane do różnicowania się w chondrocyty przy użyciu trójwymiarowych mikromasowych hodowli komórek w agregatach.
- Zawiesić 2,5 x 105 MSC w 5 ml wstępnie ogrzanego podłoża do różnicowania ChondroMAX™ (SCM123).
- Wirować komórki przy 200 g przez 5 minut.
- Usuń pożywkę i ponownie zawieś komórki w 0,5 ml wstępnie ogrzanej pożywki różnicującej ChondroMAX™.
- Wiruj komórki przy 200 g przez 5 minut. Nie usuwać pożywki.
- Odkręcić zakrętkę probówki, aby umożliwić wymianę gazową i inkubować w pozycji pionowej w temperaturze 37°C i 5% CO2.
- Po 1 - 2 dniach osad komórek utworzy okrągłą kulę o średnicy około 1 - 2 mm. Ostrożnie zmieniaj pożywkę co drugi dzień, nie uszkadzając osadu komórek mikromasy. Po 21 dniach hodowle mikromasy mogą zostać utrwalone, podzielone na sekcje i wybarwione Safraniną-O (TMS-009), Alcian-Blue (TMS-010) lub przeciwciałami w celu identyfikacji chondrocytów.


Rysunek 3.Barwienie zróżnicowanych hodowli ludzkich mezenchymalnych komórek macierzystych za pomocą Oil-Red-O (adipocyty), Alizarin-Red (osteocyty), Safranin-O (chondrocyty) i Alcian-Blue (chondrocyty).
Często zadawane pytania
- Jak długo MSC rozwijają się w hodowli? Zaleca się rozpoczęcie od komórek o niskim numerze pasażu (≤P2), ponieważ MSC rzadko rozwijają się po przejściu 5-10 (10 podwojeń populacji).
- Moje komórki już nie proliferują, co powinienem zrobić? Zaleca się rozpoczęcie od nowej, świeżej fiolki z komórkami o niskim przejściu.
- Jaka jest typowa morfologia multipotencjalnych MSC? MSC powinny mieć morfologię wrzecionowatą/fibroblastyczną. Komórki stają się większe i mniej fibroblastyczne po osiągnięciu dojrzałości.
- Jakie markery można wykorzystać do scharakteryzowania MSC? MSC wykazują jednolitą ekspresję integryny CD29, receptorów macierzy CD44, CD105 i markerów związanych z komórkami zrębowymi CD73, CD90 i CD166. Komórki są ujemne pod względem markerów linii krwiotwórczej CD14, CD31, CD34 i CD45.
- Skąd mam wiedzieć, kiedy podzielić moje MSC? Podziel komórki, gdy osiągną nie więcej niż 80% konfluencji.
- Jaka jest prawidłowa gęstość wysiewu podczas pasażowania MSC? Zalecamy wysiewanie nowych płytek komórkami z gęstością 5000 komórek/cm2
- Czy mogę użyć FBS do hodowli MSC? Podłoże zawierające niskie stężenia FBS (<1% FBS) może być stosowane do ekspansji MSC. Jednak ze względu na jego niezdefiniowany charakter, każda partia FBS musi zostać przebadana pod kątem wspierania wzrostu MSC. Polecamy PLTMax® Human Platelet Lysate (SCM141) lub pożywkę Xeno-Free MSC (SCM045), które nie wymagają takiego wstępnego badania.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?