Metody hodowli hematopoetycznych komórek macierzystych
Hematopoetyczne komórki macierzyste rezydujące w szpiku kostnym myszy zostały po raz pierwszy odkryte przez Tilla i McCullocha w latach sześćdziesiątych XX wieku i wskazały, że (1) hematopoeza może być badana jako nauka ilościowa, (2) w szpiku istniały klonalne komórki krwiotwórcze, które mogły dać początek mieszanemu potomstwu szpikowemu (granulocyty, makrofagi, krwinki czerwone, megakariocyty), (3) niektóre z tych komórek mogły się samoczynnie odnawiać i (4) w śledzionach tych myszy istniały komórki, które mogły również wytwarzać limfocyty. Cała aktywność tworzenia kolonii ludzkich komórek szpiku kostnego (BM) znajduje się we frakcji komórek progenitorowych CD34+. Badania kliniczne dotyczące przeszczepów, w których wykorzystano wzbogacone komórki CD34+ ze szpiku kostnego, pępowiny i jednojądrzastych komórek krwi obwodowej (PBMC), wykazały obecność HSC o długotrwałej zdolności do rekonstytucji tkanek. Poniżej przedstawiono powszechnie stosowane protokoły i testy hodowli komórkowej in vitro stosowane do izolacji, ekspansji, różnicowania i charakterystyki populacji ludzkich hematopoetycznych komórek macierzystych CD34+ z różnych tkanek.
Izolacja ludzkich hematopoetycznych komórek progenitorowych CD34+
HSC mogą być izolowane przy użyciu cytometrii przepływowej w oparciu o ekspresję markerów powierzchniowych. Pierwotne multipotencjalne hematopoetyczne komórki progenitorowe mają fenotypy z CD34+/CD38-/CD45RA-/CD71- ekspresja. Inne pozytywne markery progenitorów hematopoetycznych obejmują CD133+, CD90+ (Thy-1), ALDH+ oraz Sca-1+. Inne negatywne markery dla progenitorów hematopoetycznych obejmują markery dojrzałej linii krwi (Lin-): CD2-, CD3-, CD19-, CD41-, CD16-, CD14-, oraz CD15-. Idealną próbką jest świeża, antykoagulowana krew lub próbki tkanek. Szczegóły przygotowania różnią się w zależności od konkretnego źródła tkanki. Jeśli próbki nie mogą być przetworzone w ciągu 48 godzin, należy je zamrozić.
- Próbki rozcieńczyć w stosunku 1:1 w D-PBS bez Mg2+ lub Ca2+ (D8537).
- Wlej 20 ml Ficoll (F5415) do probówki o pojemności 50 ml i powoli nałóż warstwę (przechylając probówkę i przesuwając komórki po boku probówki) 25 ml rozcieńczonej krwi lub szpiku.
- Wiruj w temperaturze pokojowej 1100g przez 20 minut.
- Usuń połowę górnej warstwy i wyrzuć.
- Ostrożnie odmierz pipetą "mętną" warstwę pośrednią (~10 ml) i przenieś do czystej probówki o pojemności 50 ml. Przemyć komórki 50 ml PBS bez Mg2+ i Ca2+ (D8537).
- Zawiesić komórki w pożywce z surowicą lub białkiem (D-PBS lub Hank's z 2-6% FBS lub HSA).
- Wiruj komórki i przepłucz dwukrotnie w D-PBS bez Mg2+ i Ca2+ (D8537).
- Lizy i usuń RBC przez ponowne zawieszenie w zimnym roztworze NH4Cl (A9434) w ilości 3-4 razy większej niż oryginalna objętość próbki.
- Inkubować na lodzie przez 10 minut.
- Wirować komórki i przemyć dwukrotnie w D-PBS bez Mg2+ i Ca2+ (D8537). Zawiesić komórki w pożywce z surowicą lub białkiem (D-PBS lub Hank's z 2-6% FBS lub HSA).
- Zawieś ponownie komórki w pożywce Hanka + FBS w stężeniu 107/ml.
- Pobierz próbki komórek do kontroli (~105 komórek/ probówkę) w następujący sposób: niebarwione komórki; nieistotne kontrole przeciwciał dla FITC, fikoerytryny i Cy5; jednokolorowe kontrole pozytywne dla FITC, fikoerytryny i Cy5.
- Do pozostałych komórek dodaj odpowiednie przeciwciała dla wybranej procedury. Inkubować komórki przez 30 minut w temperaturze 4°C.
- Komórki umyć dwukrotnie i ponownie zawiesić w roztworze Hanka + FBS zawierającym 2 µg/ml jodku propidium (PI) (P4170). Komórki są teraz gotowe do sortowania.
- Przed włączeniem systemu fluidalnego, usuń filtr płynu i użyj strzykawki i tępej igły, aby wstrzyknąć wystarczającą objętość przefiltrowanego 10% wybielacza (425044), aby zalać linię próbkowania.
- Wyjmij strzykawkę, podłącz nowy, czysty filtr i ponownie zmontuj układ hydrauliczny.
- Włącz system fluidalny i przeprowadź próbówkę z przefiltrowanym 10% wybielaczem przez około 10 minut.
- Wyjmij próbówkę z wybielaczem i przepłucz linię próbkowania sterylnym płynem do osłonek.
- Przepłucz zewnętrzną część linii próbkowania alkoholem, a następnie sterylnym D-PBS. Komórki są selekcjonowane na podstawie rozpraszania do przodu i na boki oraz barwienia PI (komórki żywotne PI). Komórki są następnie sortowane pod kątem wysokiej ekspresji CD34 i niskiej ekspresji CD45, CD38 i CD71.

Rysunek 1. Markery ludzkich hematopoetycznych komórek macierzystych analizowane za pomocą cytometrii przepływowej. Charakterystyka cytometryczna ekspansji HSC w skali laboratoryjnej od różnych dawców ujawnia, że Stemline™ Hematopoietic Stem Cell Expansion Medium generuje znaczną ekspansję zarówno zaangażowanych (niebieski, CD34-/CD15+/CD41+), jak i wczesnych (czerwony, CD34+/CD15-/CD41-) hematopoetycznych komórek progenitorowych.
Ekspansja ludzkich hematopoetycznych komórek progenitorowych CD34+
- Przygotuj pożywkę do hodowli komórek. Połączyć Basal Medium i Supplement Mix z PromoCell HPC Expansion Medium DXF (C-28021) zgodnie z instrukcją. Następnie dodaj odpowiednią ilość PromoCell Cytokine Mix E (C-39890/C-39891), aby uzyskać całkowicie uzupełnione Expansion Medium. Wstępnie wyrównać odpowiednią ilość uzupełnionej pożywki w inkubatorze w temperaturze 37°C i 5% CO2 przez 30 minut.
- Płytkować komórki. Świeżo wyizolowane HPC: Umieścić HPC we wstępnie wyrównanej pożywce w gęstości 5X103 komórek/ml. Kriokonserwowane HPC: Rozmrażać komórki przez 2 minuty w łaźni wodnej. Po rozmrożeniu natychmiast przenieś je do wstępnie wyrównanej pożywki w gęstości 5000 komórek na ml. Użyj co najmniej 9 ml pożywki na fiolkę z kriokonserwowanymi komórkami.
- Inkubuj komórki przez 4 dni w temperaturze 37°C i 5% CO2. W celu częściowej wymiany pożywki należy wyjąć komórki z inkubatora. Aby utworzyć zawiesinę pojedynczych komórek, kilkakrotnie pipetuj w górę i w dół i przenieś całą zawartość naczynia do hodowli tkankowej do stożkowej probówki o pojemności 50 ml. Wirować komórki przez 10 minut z prędkością 240 x g. Następnie ostrożnie odessać górne dwie trzecie pożywki. Delikatnie ponownie zawiesić komórki w pozostałej jednej trzeciej pożywki i uzupełnić do pierwotnej objętości świeżą pożywką HPC Expansion Medium DXF uzupełnioną cytokinami (C-28021). Inkubować przez kolejne 6-8 dni, aby umożliwić wystarczającą ekspansję komórek. Wymieniaj dwie trzecie pożywki zgodnie z powyższym opisem co 3 dni.
- Zbierz komórki zbierając pożywkę z naczynia do hodowli tkankowej zawierającego ekspandowane HPC. Pipetować kilka razy w górę i w dół w celu uwolnienia luźno połączonych komórek i uzyskania zawiesiny pojedynczych komórek. Wiruj zebrane HPC z prędkością 240 x g przez 10 minut i odrzuć supernatant.
- Zawieś ponownie komórki w PromoCell HPCs Expansion Medium DXF (C-28021) i policz je. HPC są teraz gotowe do użycia w eksperymentach.

Rysunek 2. Morfologia ludzkich hematopoetycznych komórek progenitorowych CD34+. Hodowla zawiesinowa izolowanych ludzkich hematopoetycznych komórek macierzystych CD34+/CD38 pochodzących ze szpiku kostnego (A, 10X i B, 40X).
Test komórek tworzących kolonie (CFU)
Test komórek tworzących kolonie (CFU) lub test CFC jest używany do badania proliferacji i różnicowania progenitorów hematopoetycznych poprzez ich zdolność do tworzenia kolonii w półstałym podłożu, takim jak metyloceluloza lub agar. Liczba i morfologia kolonii utworzonych przez ustaloną liczbę komórek wejściowych dostarcza wstępnych informacji na temat zdolności progenitorów do różnicowania i proliferacji. Test ten jest przydatny do oceny różnicowania komórek szpikowych (granulocytarnych, monocytarnych, erytroidalnych i megakariocytarnych), ale nie limfoidalnych.
- Szybko rozmrozić fiolkę z zamrożonymi hematopoetycznymi komórkami macierzystymi CD34+ (C-12921) w temperaturze 37°C lub użyć świeżo wyizolowanych komórek.
- Przenieść 3X103 komórek do sterylnej mikroprobówki zawierającej zimny 2% FBS/IMDM. Wstępnie dostosować objętość 2% FBS/IMDM tak, aby końcowa objętość zawiesiny wynosiła około 0,3 ml.
- Zawiesić komórki i przenieść całą zawiesinę komórek o objętości 0,3 ml do 3 ml porcji rozmrożonego i uzupełnionego Hematopoietic Progenitor Expansion Medium DXF (C-28021). Na tym etapie można dodać dodatkową metylocelulozę (1%) (M7027) i dodatkowe cytokiny w celu indukcji różnicowania linii.
- Wiruj energicznie i pozostaw probówkę nieruchomo przez 3 minuty (pęcherzyki powinny unieść się do góry).
- Podłącz 16-stopniową igłę z tępym końcem do strzykawki o pojemności 3 ml i pobierz 2,2 ml. Nie zasysaj dużych pęcherzyków; usuń je na początku, wypychając kilka razy. Wyciśnij po 1,1 ml do dwóch 30 mm nietraktowanych płytek i rozprowadź mieszaninę równomiernie poprzez wirowanie i obracanie płytki.
- Umieść zduplikowane płytki w 100 mm płytce wraz z naczyniem z wodą zawierającym 3 ml sterylnej wody dla dodatkowej wilgotności. Hoduj przez 14-17 dni.
- Charakteryzuj i oceniaj kolonie zgodnie z ich morfologią za pomocą odwróconego mikroskopu przy 40-krotnym powiększeniu w naczyniu hodowlanym oznaczonym siatką punktacji.
- Do dalszej analizy różnicowania i proliferacji komórki z całej płytki testowej CFU można odzyskać przez zawieszenie w kilku objętościach 2% FBS/IMDM o temperaturze pokojowej. Po odwirowaniu przy 300 x g przez 10 minut w temperaturze 4°C, komórki są ponownie zawieszane w 2% FBS/IMDM, liczone i barwione przeciwciałami do cytometrii przepływowej lub przenoszone na szkiełka przy użyciu wirówki Cytospin do barwienia Giemsa.
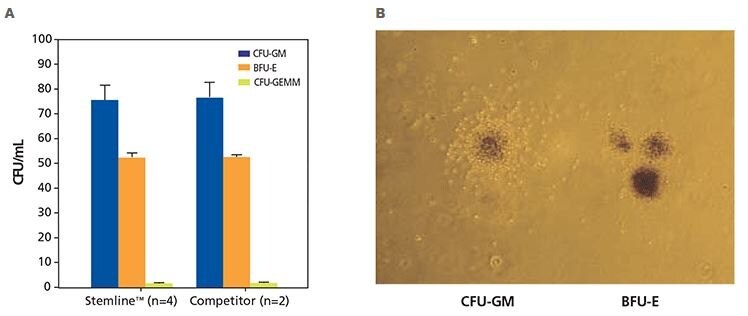
Rysunek 3. Wyniki testu tworzenia kolonii (CFU) ludzkich hematopoetycznych komórek progenitorowych CD34+. A) Ludzkie hematopoetyczne komórki macierzyste CD34+ wyizolowane z normalnego, zdrowego ludzkiego szpiku kostnego hodowano w pożywce Stemline™ HSC w metylocelulozie z Epo lub w pożywce konkurencyjnej w metylocelulozie z Epo. Hodowle oceniano po 12-16 dniach hodowli przy użyciu mikroskopu odwróconego. Hodowle oceniano pod kątem jednostek erytroidalnych (BFU-E), jednostek tworzących kolonie granulocytów i monocytów (CFU-GM) oraz jednostek tworzących kolonie granulocytów, erytrocytów, makrofagów i megakariocytów (CFU-GEMM). B) Zróżnicowane ludzkie hematopoetyczne komórki progenitorowe CD34+ wykazujące ludzką kolonię granulopoetyczną zawierającą klonogenne prekursory granulocytów i makrofagów (CFU-GM) oraz ludzką kolonię progenitorową erytroidalną (BFU-E). Kolonie CFU-GM wykazują stosunkowo jednorodną morfologię i zazwyczaj mają skoncentrowany centralny rdzeń komórek otoczony mniej gęstą otoczką komórek. Kolonie BFU-E są często określane jako posiadające morfologię przypominającą winogrona i różnią się wielkością od pojedynczego, dużego skupiska zawierającego kilkaset erytroblastów do 14 lub więcej skupisk zawierających tysiące komórek (powiększenie 40x).
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?