Protokół znakowania egzosomów barwnikami lipofilowymi PKH
Ekosomy to mikroskopijne pęcherzyki zewnątrzkomórkowe obecne w większości płynów somatycznych, w tym we krwi i moczu, a także w pożywkach hodowli komórkowych. Te zawierające lipidy mikropęcherzyki mają wielkość od 30 do 100 nm. Ponieważ często zawierają one kluczowe biomolekuły, takie jak białka i kwasy nukleinowe (zarówno DNA, jak i RNA) pochodzące z ich komórki pochodzenia, egzosomy wzbudziły zainteresowanie ze względu na ich potencjał jako celów terapii przeciwnowotworowych. Ostatnie badania potwierdzają, że egzosomy są zaangażowane w komunikację międzykomórkową, sygnalizację i odpowiedź immunologiczną, a także zarządzanie odpadami komórkowymi.
PKH i CellVue® Fluorescent Cell Linker Kits zapewniają fluorescencyjne znakowanie żywych komórek przez dłuższy czas, bez widocznych efektów toksycznych. Te łączniki komórkowe wykorzystują selektywny podział w celu włączenia alifatycznych cząsteczek reporterowych do dwuwarstwy lipidowej błony plazmatycznej. Barwnik błonowy PKH67 jest zielonym fluorochromem o wzbudzeniu (490 nm) i emisji (504 nm) podobnym do fluoresceiny i FITC.PKH26 jest fluorochromem w widmie czerwonym o szczytowej charakterystyce wzbudzenia (551 nm) i emisji (567 nm) zgodnej z kanałami detekcji rodaminy lub fikoerytryny (PE) i może być również wzbudzany laserem o długości fali 488 nm.CellVue® Claret to fluorochrom dalekiej czerwieni, na który nie ma wpływu pH w zakresach fizjologicznych, a jego charakterystyka wzbudzenia (655 nm) i emisji (675 nm) jest zgodna z laserem dalekiej czerwieni.
Barwniki PKH zostały z powodzeniem wykorzystane do znakowania egzosomów i pęcherzyków zewnątrzkomórkowych w in vitro i in vivo eksperymentach śledzenia. Poniższy protokół znakowania egzosomów szczegółowo opisuje etapy niezawodnego znakowania fluorescencyjnego egzosomów przy użyciu barwników PKH do eksperymentów śledzenia mikropęcherzyków.
Wyświetl publikacje PKH/Eksosomy
Protokół znakowania egzosomów
- Zacznij od świeżo wyizolowanych peletek egzosomów przygotowanych z ultrawirowania lub mikrofiltracji.Protokół izolacji egzosomów
- Ochłodzić ultrawirówkę do temperatury 2-8°C.
- Połączyć osady z wielu probówek w jedną probówkę dla każdej próbki i zmierzyć całkowitą objętość.
- Zwiększ objętość próbki osadu do 1 ml przy użyciu rozcieńczalnika C z PKH67 (PKH67GL, MINI67, MIDI67) lub PKH26 (PKH26GL, MINI26, MIDI26) dla każdej próbki.
- Określić próbkę osadu o największej objętości i dodać tę objętość pożywki wolnej od egzosomów do nowej probówki do ultrawirówki. Doprowadzić objętość do 1 ml za pomocą rozcieńczalnika C.
- Dodaj 6uL barwnika PKH67 lub PKH26 do każdej z 1mL probówek z rozcieńczalnikiem C z kroków 4-5.
- Mieszaj w sposób ciągły przez 30 sekund, delikatnie pipetując. Pozostawić w temperaturze pokojowej na 5 minut.
- Skrócić dodając 2 ml 10% BSA (A9418) w PBS (D8537). Doprowadź objętość do 8,5 ml w pożywce bez surowicy.
- Przygotuj 0,971 M roztwór sacharozy (S1888).
- Dodaj 1,5 ml roztworu sacharozy, pipetując powoli i ostrożnie na dno probówki, upewniając się, że nie powstają turbulencje. Roztwór egzosomów-PKH67 pozostanie na wierzchu poduszki sacharozy.
- Wiruj z prędkością 190 000 G przez 2 godziny w temperaturze 2-8°C.
Uwaga: Egzosomy będą w pelecie, a większość nadmiaru barwnika powinna znajdować się w warstwie interfejsu. - Ostrożnie odessać pożywkę i warstwę pośrednią.
- Zawiesić osad egzosomów w 1X PBS (D8537) przez delikatne pipetowanie.
- Przenieść do kolumny filtracyjnej Amicon 10 kDa MWCO (odcięcie masy cząsteczkowej). Dodaj 9 ml PBS, 0,75 ml pożywki.
- Wiruj z prędkością 3000 x g w wirówce wysokoobrotowej przez 40 minut i wykonaj tyle krótszych wirowań, ile potrzeba, aby zmniejszyć objętość do 0,5-1 ml.
- Odzyskaj koncentrat z kolumny Amicon, przechowuj w probówce na lodzie. Użyj znakowanych egzosomów tak szybko, jak to możliwe, aby zapewnić najwyższą możliwą intensywność fluorescencji.
Analiza znakowanych egzosomów przy użyciu cytometrii przepływowej Amnis® Imaging

Rysunek 1. Komórkowy wychwyt egzosomów. Egzosomy z komórek SW780 zostały wyizolowane i wyznakowane PKH26. Znakowane egzosomy hodowano z komórkami SW780 przez 17 godzin i analizowano za pomocą urządzenia do cytometrii przepływowej Amnis® ImageStream. Jasne plamy PKH26 były widoczne w komórkach hodowanych z obciążonymi egzosomami, a nie były widoczne w komórkach kontrolnych.
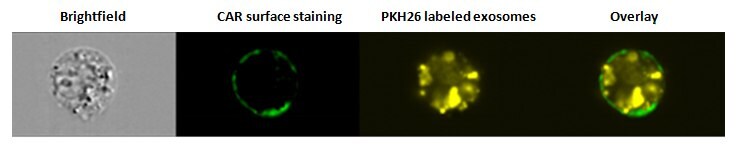
Rysunek 2. Internalizacja egzosomów. Komórki SW780 wybarwiono markerem powierzchniowym CAR (Coxsackie and Adenovirus Receptor) po pobraniu egzosomu znakowanego PKH26 i przeanalizowano za pomocą cytometru przepływowego Amnis® ImageStream. Nałożony obraz pokazuje, że egzosomy zostały zinternalizowane.

Rysunek 3. Stabilność przechowywania egzosomów. Egzosomy zostały wyizolowane i wybarwione PKH26. Znakowane PKH26 egzosomy dodawano natychmiast do hodowli SW780 lub przechowywano przez noc w temperaturze 2-8 °C lub 20 °C. Po całonocnym przechowywaniu egzosomy dodawano do hodowli SW780 i analizowano za pomocą urządzenia do cytometrii przepływowej Amnis® ImageStream. We wszystkich próbkach wychwyt mierzono po 4 godzinach w hodowli. Pobór egzosomów można wykryć w hodowlach wykorzystujących przechowywane egzosomy, ale można zaobserwować pewną utratę intensywności fluorescencji.

Rysunek 4. Specyficzność wychwytu egzosomów. Komórki SW780 hodowano z egzosomami znakowanymi PKH i zbierano do analizy. Próbkę poddano działaniu trypsyny w celu określenia, czy spowoduje to usunięcie egzosomów. Próbkę hodowano w temperaturze 2-8 °C, a do innej hodowli dodano azydek sodu. Wykrywanie egzosomów jest odporne na trypsynę. Jednakże nie stwierdzono wychwytu egzosomów ani w hodowli w temperaturze 2-8 °C, ani w hodowli poddanej działaniu azydku sodu.
Dane dzięki uprzejmości Patricii Simms, Core Facility Manager, Flow Cytometry Core Facility, Loyola University, Chicago
CellVue® zastrzeżony znak towarowy PTI Research Inc./b>
CellVue® jest zastrzeżonym znakiem towarowym PTI Research, Inc
Amnis®, FlowSight®, ImageStream®, Guava® and Muse® są zastrzeżonymi znakami towarowymi Merck KGaA, Darmstadt, Niemcy
Duolink® jest zastrzeżonym znakiem towarowym Sigma-Aldrich Co
Duolink® jest zastrzeżonym znakiem towarowym Sigma-Aldrich Co.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?