The Endothelial Cell Transwell Migration and Invasion Assay
Angiogeneza jest ściśle regulowanym wydarzeniem komórkowym, które jest równoważone przez sygnały pro- i antyangiogenne, w tym integryny, chemokiny, angiopoetyny, czynniki wyczuwające tlen, cząsteczki łączące i endogenne inhibitory.4 Podczas gdy fizjologiczna angiogeneza jest wysoce zorganizowana, patologiczna angiogeneza jest mniej dobrze kontrolowana, a naczynia rzadko dojrzewają, przebudowują się lub cofają w odpowiedzi na chorobę.5 Since endothelial cell migration and invasion are essential to angiogenesis, the so-called transwell cell testy migracji i inwazji są pomocnymi narzędziami do badania mechanizmów leżących u podstaw zdarzeń angiogenicznych. Migrację komórek można po prostu zdefiniować jako proces, w którym komórki przemieszczają się z jednej lokalizacji do drugiej, kierowane przez zewnętrzne sygnały biochemiczne. Z drugiej strony, inwazja komórek mierzy zdolność komórek śródbłonka do przemieszczania się przez matrycę 3D (taką jak błony podstawne). Jest to złożony wieloetapowy proces, który obejmuje adhezję, proteolizę składników ECM, reorganizację mikrośrodowiska i migrację przez macierz.6
Badania in vitro test migracji, znany również jako test komory Boydena, jest stosowany do pomiaru migracji komórek śródbłonka wzdłuż gradientu cytokin (chemotaksja) oraz do pomiaru zdolności chemotaktycznych badanych substancji in vitro. Obejmuje ona dwa wypełnione pożywką przedziały oddzielone mikroporowatą membraną. Z reguły komórki umieszcza się w górnym przedziale i pozwala się im migrować przez pory membrany do dolnego przedziału, w którym obecne są czynniki chemotaktyczne. Po odpowiednim czasie inkubacji membrana między dwoma przedziałami jest utrwalana i określana jest liczba komórek, które migrowały do dolnej części.
Test inwazji in vitro mierzy migrację komórek śródbłonka przez macierz zewnątrzkomórkową. Invasive migration is a major process in angiogenesis but also plays a significant role in pathological events such as cancer development and metastasis.9 Like the transwell migration assay, the cell invasion assay involves two compartments separated by a membrane with a precisely defined pore size. Membrana jest pokryta matrycą naśladującą błonę podstawną naczyń krwionośnych. Potencjalny czynnik chemotaktyczny jest umieszczany w jednym przedziale, a gradient tworzy się w poprzek membrany. Komórki śródbłonka wprowadzone do drugiego przedziału degradują matrycę, a następnie migrują wzdłuż tego gradientu. Po odpowiednim czasie inkubacji, komórki, które migrowały przez membranę można policzyć po utrwaleniu membrany i zabarwieniu ich.9

Rysunek 1.Przebieg testów transmigracji i inwazji komórek śródbłonka.
Endothelial Cell Transwell Migration and Invasion Assay Protocols
Transmigration Assay Protocol
1. Prepare a culture of endothelial cells. Umieść komórki śródbłonka PromoCell w ilości 5X103 komórek/cm2 (lub zgodnie z zaleceniami zawartymi w instrukcji obsługi danego produktu) w odpowiednim naczyniu hodowlanym, stosując zalecaną pożywkę do wzrostu śródbłonka. Wymieniać podłoże hodowlane co 2-3 dni. Pozwól komórkom osiągnąć 70-90% konfluencji.
2. Przygotuj pożywkę testową. Przygotuj odpowiednią ilość pożywki testowej, dodając 10% FBS do pożywki podstawowej dla komórek śródbłonka (np. 9 ml pożywki podstawowej + 1 ml FBS).
3. Dostosuj pożywkę i odczynniki do temperatury pokojowej.Wstępnie ogrzać pożywkę testową i składniki zestawu PromoCell DetachKit w temperaturze pokojowej przez 1-2 godziny.
4. Przygotować pożywkę testową. Rozpuścić badaną substancję w pożywce testowej. Należy użyć 750 μL pożywki testowej na studzienkę płytki 24-dołkowej. Zalecamy przygotowanie jednej dodatkowej pożywki testowej z 20 ng/mL VEGF lub bFGF do stosowania jako kontrola pozytywna. Jako kontrolę ujemną można zastosować pożywkę testową bez żadnego czynnika chemotaktycznego.
5. Przygotuj 24-dołkowe płytki i dodaj pożywkę testową. Umieść wkładki hodowli komórkowej w studzienkach 24-dołkowej płytki. Dodaj 750 μL pożywki testowej do zewnętrznego przedziału każdej studzienki.
6. Odłącz komórki śródbłonka. Komórki śródbłonka powinny być zbieżne w 70-90%. Usuń pożywkę z naczynia hodowlanego i przemyj komórki dodając 200 μL/cm2 PBS (D8537). Usuń PBS i dodaj 100 μL/cm2 Trypsyna/EDTA (T3924). Zamknij naczynie i zbadaj komórki pod mikroskopem. Gdy komórki zaczną się oddzielać, delikatnie postukaj w bok naczynia, aby rozluźnić pozostałe komórki. Zneutralizuj roztwór trypsyny dodając 100 μL/cm2 Trypsin Neutralization Solution (T6414) i delikatnie wstrząsaj naczyniem hodowlanym przez 30 sekund.
7. Przelicz komórki. Przenieś zawiesinę komórek do probówki wirówkowej i wiruj probówkę z prędkością 220 x g przez 4 minuty w temperaturze pokojowej. Usunąć supernatant i ponownie zawiesić osad komórkowy w 5 ml pożywki testowej. Określić liczbę komórek zgodnie ze standardową procedurą.
8. Nasiać komórki we wkładkach do hodowli komórkowej. Rozcieńczyć stężenie komórek do 1x 105 komórek/mL pożywką testową. Ostrożnie dodaj 500 μL zawiesiny komórek (= 5X104 komórek) do wkładek hodowli komórkowej w 24-dołkowej płytce.
9. Rozpocznij eksperyment transmigracji. Inkubuj komórki w 24-dołkowych płytkach w nawilżonym inkubatorze (37 °C, 5% CO2) przez 3-6 godzin. W czasie inkubacji w poprzek błony powstaje gradient badanej substancji. Komórki migrują przez pory wzdłuż gradientu do dolnej strony membrany i tam przylegają.
10. Usuń niezmigrowane komórki z górnej strony membrany. Ostrożnie usuń pożywkę ze wszystkich wkładek do hodowli komórkowych. Następnie wyjąć wkładki za pomocą pęsety i odessać pożywkę z każdego dołka. Po włożeniu wkładów z powrotem do dołka, usuń niezmigrowane komórki z górnej strony membrany za pomocą bawełnianego wacika. Wprowadzić pipetą PBS do szczeliny między studzienką a wkładką.
11. Postępować z utrwalaniem i barwieniem migrujących komórek.
Protokół testu inwazji
1. Przygotuj hodowlę komórek śródbłonka. Umieść komórki śródbłonka PromoCell w ilości 5X103 komórek/cm2 w odpowiednim naczyniu hodowlanym, stosując zalecaną pożywkę do wzrostu śródbłonka. Wymieniać podłoże hodowlane co 2-3 dni. Pozwól komórkom osiągnąć 70-90% konfluencji.
2. Przygotuj komory do testów inwazyjnych i dostosuj pożywki i odczynniki do odpowiednich temperatur. Przygotuj odpowiednią ilość pożywki testowej, dodając 10% FBS do pożywki podstawowej dla komórek śródbłonka (np. 9 ml pożywki podstawowej + 1 ml FBS). Dodaj 750 μL pożywki testowej do każdego dołka i 500 μL żelu Matrigel/ECM Gel do wkładu do hodowli komórkowej. Umieść 24-dołkową płytkę w nawilżonym inkubatorze (37 °C, 5% CO2) na 1-2 godziny.
3. Przygotuj pożywkę testową. Rozpuść badaną substancję w pożywce testowej. Należy użyć 750 μL pożywki testowej na studzienkę płytki 24-dołkowej. Zalecamy przygotowanie jednej dodatkowej pożywki testowej z 20 ng/mL VEGF lub bFGF do stosowania jako kontrola pozytywna. Jako kontrolę ujemną można zastosować pożywkę testową bez żadnego czynnika chemotaktycznego.
4. Dodaj pożywkę testową do studzienek. Wyjmij wkładki pokryte żelem Matrigel/ECM ze studzienek płytki 24-dołkowej za pomocą pęsety i odessaj pożywkę testową z każdej studzienki. Po włożeniu wkładek z powrotem do dołków, odpipetuj 750 μL pożywki testowej do szczeliny między dołkiem a wkładką.
5. Odłącz komórki śródbłonka. Komórki śródbłonka powinny być w 70-90% konfluentne. Usuń pożywkę z naczynia hodowlanego i przemyj komórki dodając 200 μL/cm2 PBS (D8537). Usuń PBS i dodaj 100 μL/cm2 Trypsyna/EDTA (T3924). Zamknij naczynie i zbadaj komórki pod mikroskopem. Gdy komórki zaczną się oddzielać, delikatnie postukaj w bok naczynia, aby rozluźnić pozostałe komórki. Zneutralizować roztwór trypsyny przez dodanie 100 μL/cm2 Roztworu neutralizującego trypsynę (T6414) i delikatnie wstrząsać naczyniem hodowlanym przez 30 sekund.<6. Przelicz komórki. Przenieś zawiesinę komórek do probówki wirówkowej i wiruj probówkę z prędkością 220 x g przez 4 minuty w temperaturze pokojowej. Usunąć supernatant i ponownie zawiesić osad komórkowy w 5 ml pożywki testowej. Określić liczbę komórek zgodnie ze standardową procedurą.
7. Nasiać komórki we wkładkach do hodowli komórkowej pokrytych żelem Matrigel/ECM. Rozcieńczyć stężenie komórek do 1x105 komórek/ml pożywką testową. Usunąć pożywkę testową z płytek pokrytych żelem Matrigel bez dotykania powierzchni pokrytej żelem Matrigel. Ostrożnie dodaj 500 μL zawiesiny komórek (= 5X104 komórek) do wkładek do hodowli komórkowej.
8. Rozpocznij eksperyment inwazji.Inkubować komórki we wkładkach pokrytych Matrigelem w nawilżonym inkubatorze (37°C, 5% CO2) przez 16-28 godzin. W czasie inkubacji w poprzek błony powstaje gradient badanej substancji. W przypadku pozytywnej stymulacji przez substancję testową komórki degradują matrycę, migrują przez pory wzdłuż gradientu do dolnej strony membrany i tam przylegają.
9. Usuń niezmigrowane komórki z górnej strony membrany. Ostrożnie usuń pożywkę ze wszystkich wkładek pokrytych żelem Matrigel/ECM. Następnie wyjąć wkładki za pomocą pęsety i odessać pożywkę z każdego dołka. Po włożeniu wkładek z powrotem do dołka, usunąć niezmigrowane komórki z górnej strony membrany za pomocą bawełnianego wacika. Odmierzyć pipetą 750 μL PBS do szczeliny między studzienką a wkładką.
10. Postępować z utrwalaniem i barwieniem migrujących komórek.
Analiza migrujących komórek
Utrwalanie i barwienie komórek
1.Ostrożnie usunąć PBS ze studzienek i dodać 750 μL zimnego metanolu (34860) (4 °C) do studzienek. Inkubować przez 20 minut w temperaturze pokojowej. Ostrożnie usuń metanol i odczekaj 30 minut. W tym czasie membrana wyschnie na powietrzu. Po wysuszeniu membranę można przechowywać w temperaturze 4°C i przetworzyć później.
2. Stain the cells.Dodaj 750 μL fioletu krystalicznego (V5265) do studzienek i inkubuj przez 20 minut w temperaturze pokojowej.
3.Ostrożnie usunąć roztwór barwiący i trzykrotnie dokładnie przemyć wodą destylowaną.
4.
Analiza
1. Wizualna kwantyfikacja. Wlać 750 μL wody destylowanej do studzienek 24-dołkowej płytki i policzyć migrujące komórki w dolnej części membrany za pomocą odwróconego mikroskopu.
2. Kolorymetryczna kwantyfikacja za pomocą czytnika mikropłytek. Wlać 750 μL 10% kwasu octowego (A6283) do studzienek i inkubować przez 30 sekund, ostrożnie wstrząsając 24-dołkową płytką. Komórki na membranie zostaną zlizowane przez kwas octowy, a fiolet krystaliczny w komórkach zostanie uwolniony. Wyjmij wkładkę z 24-dołkowej płytki i odczytaj gęstość optyczną 10% kwasu octowego przy 595 nm za pomocą czytnika mikropłytek.
Wyniki
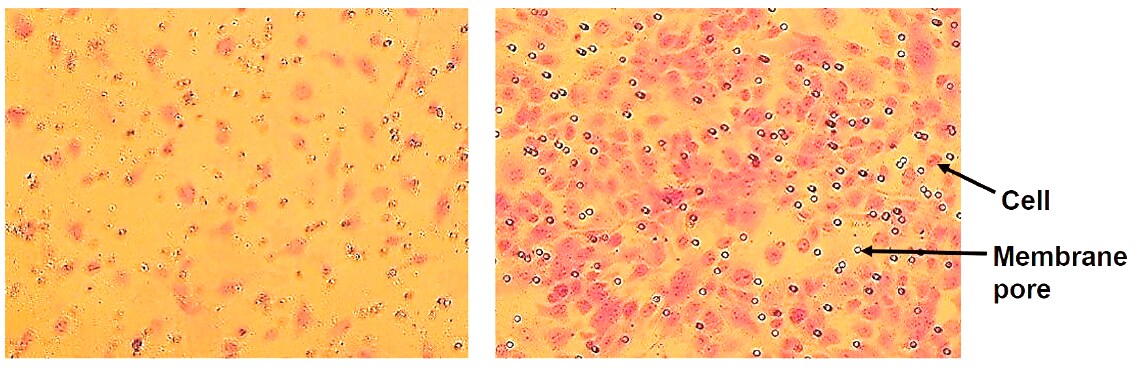
Rysunek 2.Migracja komórek śródbłonka in vitro stymulowana przez VEGF. Komórki, które migrowały przez błonę bez VEGF (po lewej) i z 20 ng/ml VEGF w pożywce (po prawej). Komórki wybarwiono fioletem krystalicznym.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?