PF037
MMP-2, proenzym, ludzki, rekombinowany, komórki myszy
Synonim(y):
Żelatynaza A, żelatynaza 72 kDa, metaloproteinaza macierzy 2
Zaloguj sięWyświetlanie cen organizacyjnych i kontraktowych
About This Item
Polecane produkty
rekombinowane
expressed in mouse cell line
Poziom jakości
Próba
≥90% (SDS-PAGE)
Formularz
liquid
nie zawiera
preservative
producent / nazwa handlowa
Calbiochem®
warunki przechowywania
OK to freeze
avoid repeated freeze/thaw cycles
Warunki transportu
wet ice
temp. przechowywania
−70°C
Opis ogólny
Rekombinowany ludzki pro-MMP-2 wyrażany w komórkach myszy. Przydatny do immunoblottingu, rozszczepiania substratu i zymografii testowej. Oczyszczony proenzym MMP-2 o masie ~72 kDa może być stosowany jako kontrola pozytywna lub wzorzec do analizy zymograficznej, immunoblottingu lub testów rozszczepiania substratu. Wymaga aktywacji przed użyciem. Metaloproteinazy macierzy są członkami unikalnej rodziny enzymów proteolitycznych, które mają jon cynku w swoich miejscach aktywnych i mogą rozkładać kolageny, elastynę i inne składniki macierzy zewnątrzkomórkowej (ECM). Enzymy te są obecne u zdrowych osób i wykazano, że odgrywają ważną rolę w procesach takich jak gojenie się ran, ciąża i resorpcja kości. Jednak nadekspresja i aktywacja MMP została powiązana z szeregiem procesów patologicznych i stanów chorobowych związanych z rozpadem i przebudową ECM. Choroby te obejmują inwazję i przerzuty nowotworowe, reumatoidalne zapalenie stawów, choroby przyzębia i procesy naczyniowe, takie jak angiogeneza, hiperplazja błony wewnętrznej, miażdżyca i tętniaki. Ostatnio MMP zostały powiązane z chorobami neurodegeneracyjnymi, takimi jak choroba Alzheimera i stwardnienie zanikowe boczne (ALS). Istnieją naturalne inhibitory MMP, tkankowe inhibitory metaloproteinaz macierzy (TIMP), a także opracowano syntetyczne inhibitory, które dają nadzieję na nowe możliwości leczenia tych chorób.
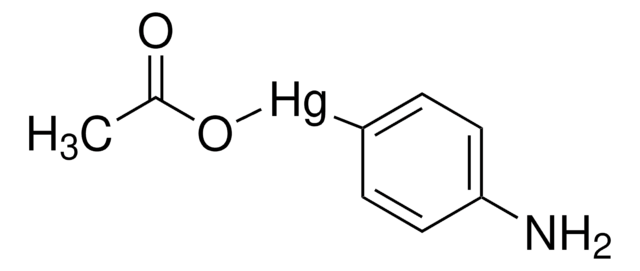
Regulacja aktywności MMP może zachodzić na poziomie ekspresji genów, w tym transkrypcji i translacji, na poziomie aktywacji lub na poziomie hamowania przez TIMP. Zatem zaburzenia w każdym z tych punktów mogą teoretycznie prowadzić do zmian w obrocie ECM. Ekspresja jest ściśle kontrolowana przez cytokiny pro- i przeciwzapalne i/lub czynniki wzrostu, a po wyprodukowaniu enzymy są zwykle wydzielane jako nieaktywne zymogramy. Po aktywacji (usunięciu hamującego regionu propeptydowego cząsteczek) MMP podlegają kontroli przez lokalnie wytwarzane TIMP1. Wszystkie MMP mogą być aktywowane in vitro związkami organomerkurialnymi (np. octanem 4-aminofenylomocznika), ale czynniki odpowiedzialne za fizjologiczną aktywację wszystkich MMP nie zostały jasno zdefiniowane. Liczne badania wskazują, że członkowie rodziny MMP mają zdolność do wzajemnej aktywacji13. Aktywacja MMP in vivo jest prawdopodobnie krytycznym krokiem w zakresie ich biologicznego zachowania, ponieważ to właśnie ta aktywacja przechyli równowagę na korzyść degradacji ECM. Cechą charakterystyczną chorób z udziałem MMP wydaje się być brak równowagi stechiometrycznej między aktywnymi MMP i TIMP, co prowadzi do nadmiernego rozerwania tkanki i często jej degradacji. Określenie mechanizmów, które kontrolują tę nierównowagę, może otworzyć kilka ważnych opcji terapeutycznych specyficznych inhibitorów enzymów.
Regulacja aktywności MMP może zachodzić na poziomie ekspresji genów, w tym transkrypcji i translacji, na poziomie aktywacji lub na poziomie hamowania przez TIMP. Zatem zaburzenia w każdym z tych punktów mogą teoretycznie prowadzić do zmian w obrocie ECM. Ekspresja jest ściśle kontrolowana przez cytokiny pro- i przeciwzapalne i/lub czynniki wzrostu, a po wyprodukowaniu enzymy są zwykle wydzielane jako nieaktywne zymogramy. Po aktywacji (usunięciu hamującego regionu propeptydowego cząsteczek) MMP podlegają kontroli przez lokalnie wytwarzane TIMP1. Wszystkie MMP mogą być aktywowane in vitro związkami organomerkurialnymi (np. octanem 4-aminofenylomocznika), ale czynniki odpowiedzialne za fizjologiczną aktywację wszystkich MMP nie zostały jasno zdefiniowane. Liczne badania wskazują, że członkowie rodziny MMP mają zdolność do wzajemnej aktywacji13. Aktywacja MMP in vivo jest prawdopodobnie krytycznym krokiem w zakresie ich biologicznego zachowania, ponieważ to właśnie ta aktywacja przechyli równowagę na korzyść degradacji ECM. Cechą charakterystyczną chorób z udziałem MMP wydaje się być brak równowagi stechiometrycznej między aktywnymi MMP i TIMP, co prowadzi do nadmiernego rozerwania tkanki i często jej degradacji. Określenie mechanizmów, które kontrolują tę nierównowagę, może otworzyć kilka ważnych opcji terapeutycznych specyficznych inhibitorów enzymów.
Opakowanie
Należy zapoznać się z etykietą fiolki, aby uzyskać informacje o stężeniu specyficznym dla partii.
Ostrzeżenie
Toksyczność: Standardowa obsługa (A)
Postać fizyczna
W 150 mM NaCl, 20 mM Tris-HCl, 5 mM CaCl₂, 0,05% detergentu BRIJ®-35, pH 7,4.
Rekonstytucja
Po wstępnym rozmrożeniu, podzielić i zamrozić (-70°C).
Komentarz do analizy
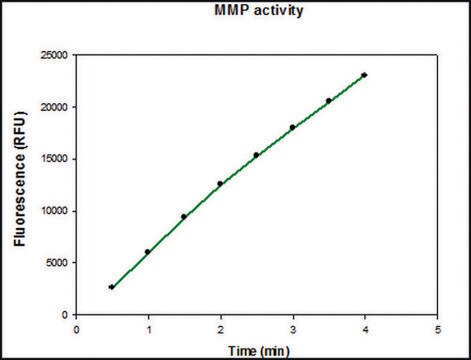
Aktywność właściwa: Mierzona zdolnością do degradacji żelatyny przy użyciu zymografii. 1 ng enzymu wystarcza do wizualizacji zdegradowanej żelatyny za pomocą niebieskiego barwnika coomassie w zymografii. Aktywowany rhMMP-2 degraduje kolagen typu IV, wizualizowany przez SDS-PAGE i rozszczepia substrat peptydu kumarynowego, (7-metoksy-kumaryno-4-ylo) Acetylo-Pro-Leu-Gly-Leu-(3-[2, 4-dinitrofenylo-L-2, 3-diaminopropionylo)-Ala-Arg-NH2 (nr kat. 03-32-5032), mierzony fluorescencją (wzbudzenie przy 320 nm i emisja przy 405 nm).
Inne uwagi
Buisson-Leqendre, N., et al. 2004. Arth. Rheumat.50, 2151.
Parsons, S.L., et al. 1997. Br. J. Surg.84, 160.
Backstrom, J.R., et al. 1996. J. Neuro.16, 7910.
Lim, G.P., et al. 1996. J. Neurochem.67, 251.
Xia, T., et al. 1996. Biochim. Biophys. Acta1293, 259.
Chandler, S. et al. 1995. Neurosci. Lett.201, 223.
Sang, Q.X., et al. 1995. Biochim. Biophys. Acta1251, 99.
Kenagy, R.D. i Clowes, A.W., 1994. Inhibicja metaloproteinaz macierzy: Therapeutic Potential. Greenwald, R.A. and Golub L.M., Eds. 462.
Kleiner, D.E. and Stetler-Stevenson W.G., 1994. Anal. Biochem.218, 325.
Zempo, N., et al. 1994. J. Vasc. Surg.20, 209.
Birkedal-Hansen, H. 1993. J. Periodontol.64 474.
Stetler-Stevenson, W.G., et al. 1993. FASEB J.7, 1434.
Delaisse, J-M. i Vaes, G. 1992. W Biologia i fizjologia osteoklastów. B.R. Rifkin & C.V. Gay, Eds. 290.
Jeffrey, J.J. 1992. In Wound Healing: Biochemical and Clinical Aspects. R.F. Diegelmann and W.J. Lindblad, Eds. 177.
Jeffrey, J.J. 1991. Semin. Perinatol.15, 118.
Liotta, L.A., et al. 1991. Cell64, 327.
Harris, E. 1990. N. Engl. J. Med.322, 1277.
Heussen, C. and Dowdle, E.B., 1980. Anal. Biochem.102, 196.
Parsons, S.L., et al. 1997. Br. J. Surg.84, 160.
Backstrom, J.R., et al. 1996. J. Neuro.16, 7910.
Lim, G.P., et al. 1996. J. Neurochem.67, 251.
Xia, T., et al. 1996. Biochim. Biophys. Acta1293, 259.
Chandler, S. et al. 1995. Neurosci. Lett.201, 223.
Sang, Q.X., et al. 1995. Biochim. Biophys. Acta1251, 99.
Kenagy, R.D. i Clowes, A.W., 1994. Inhibicja metaloproteinaz macierzy: Therapeutic Potential. Greenwald, R.A. and Golub L.M., Eds. 462.
Kleiner, D.E. and Stetler-Stevenson W.G., 1994. Anal. Biochem.218, 325.
Zempo, N., et al. 1994. J. Vasc. Surg.20, 209.
Birkedal-Hansen, H. 1993. J. Periodontol.64 474.
Stetler-Stevenson, W.G., et al. 1993. FASEB J.7, 1434.
Delaisse, J-M. i Vaes, G. 1992. W Biologia i fizjologia osteoklastów. B.R. Rifkin & C.V. Gay, Eds. 290.
Jeffrey, J.J. 1992. In Wound Healing: Biochemical and Clinical Aspects. R.F. Diegelmann and W.J. Lindblad, Eds. 177.
Jeffrey, J.J. 1991. Semin. Perinatol.15, 118.
Liotta, L.A., et al. 1991. Cell64, 327.
Harris, E. 1990. N. Engl. J. Med.322, 1277.
Heussen, C. and Dowdle, E.B., 1980. Anal. Biochem.102, 196.
Informacje prawne
Brij is a registered trademark of Croda International PLC
CALBIOCHEM is a registered trademark of Merck KGaA, Darmstadt, Germany
Ta strona może zawierać tekst przetłumaczony maszynowo.
Kod klasy składowania
10 - Combustible liquids
Klasa zagrożenia wodnego (WGK)
WGK 1
Temperatura zapłonu (°F)
Not applicable
Temperatura zapłonu (°C)
Not applicable
Certyfikaty analizy (CoA)
Poszukaj Certyfikaty analizy (CoA), wpisując numer partii/serii produktów. Numery serii i partii można znaleźć na etykiecie produktu po słowach „seria” lub „partia”.
Masz już ten produkt?
Dokumenty związane z niedawno zakupionymi produktami zostały zamieszczone w Bibliotece dokumentów.
Klienci oglądali również te produkty
M T Kato et al.
Caries research, 44(3), 309-316 (2010-06-17)
It is known that some metal salts can inhibit matrix metalloproteinase (MMP) activity, but the effect of iron has not been tested yet. On the other hand, it has recently been suggested that MMP inhibition might influence dentine erosion. Based
Cintia Silveira et al.
Caries research, 48(6), 549-556 (2014-07-06)
The aim of this study was to analyze the effect of solutions containing saturated anacardic acid (AA) on dentine erosion in vitro. AA was chemically isolated from natural cashew nutshell liquid obtained by continuous extraction in a Soxhlet extractor and
Catalina Vallejo-Giraldo et al.
Frontiers in bioengineering and biotechnology, 8, 601704-601704 (2020-11-27)
The development of 3D neural tissue analogs is of great interest to a range of biomedical engineering applications including tissue engineering of neural interfaces, treatment of neurodegenerative diseases and in vitro assessment of cell-material interactions. Despite continued efforts to develop
Nasz zespół naukowców ma doświadczenie we wszystkich obszarach badań, w tym w naukach przyrodniczych, materiałoznawstwie, syntezie chemicznej, chromatografii, analityce i wielu innych dziedzinach.
Skontaktuj się z zespołem ds. pomocy technicznej