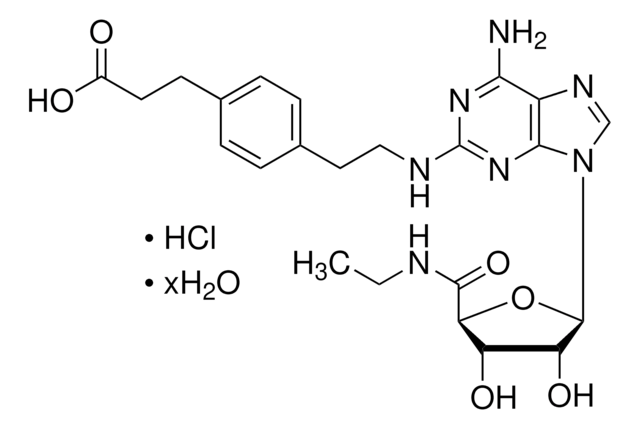
CC1043
MMP-14, ludzka, prodomena, domena katalityczna i domena hemopeksyny, rekombinowana w E. coli
Synonim(y):
MT1-MMP
Zaloguj sięWyświetlanie cen organizacyjnych i kontraktowych
About This Item
Kod UNSPSC:
12352204
eCl@ss:
32160405
NACRES:
NA.41
Polecane produkty
pochodzenie biologiczne
human
Poziom jakości
Formularz
liquid
producent / nazwa handlowa
Chemicon®
stężenie
0.2 μg/μL
numer dostępu NCBI
numer dostępu UniProt
Warunki transportu
dry ice
informacje o genach
human ... MMP14(4323)
Opis ogólny
CC1043 jest rekombinowaną sekwencją polipeptydową wytwarzaną jako białko peryplazmatyczne w E. coli. Proenzym składa się z reszt MT1-MMP odpowiadających Ser1-Val501, po których następuje jedna reszta Thr i sześć reszt His. Obliczony Mr rekombinowanego rozpuszczalnego proenzymu wynosi 58200 Da.
TŁO: Metaloproteinazy macierzy (MMP) są endopeptydazami zależnymi od Zn2+ i Ca2+, które funkcjonują w obrocie składników macierzy zewnątrzkomórkowej [Matrisian, 1992]. Obecnie wiadomo, że u kręgowców ekspresji ulega osiemnaście wydzielanych MMP i pięć MMP typu błonowego [Sato i in., 1994; Will i Hinzmann, 1995; Takino i in., 1995; Puente i in., 1996]. Ludzka MT1-MMP składa się z 559 reszt aminokwasowych o obliczonym Mr wynoszącym 63516 [Sato i in., 1994; Will i Hinzmann, 1995]. W MT1-MMP wyróżnia się następujące domeny i regiony sekwencji: domena pro (Ser1-Arg88), domena katalityczna (Tyr89-Gly261), połączenie między domeną katalityczną a domeną hemopeksyny (Gly262-Gly292), domena podobna do hemopeksyny (Pro293-Cys485) i sekwencja C-końcowa (Pro486-Val559) z segmentem transmembranowym. Rozpuszczalna forma MT1-MMP bez segmentu transmembranowego została znaleziona w pożywce hodowlanej linii komórkowej raka piersi [Imai i in., 1996].
MT1-MMP ulega ekspresji w dorosłych płucach, łożysku, nerkach, jajnikach, jelitach, prostacie i śledzionie [Will & Hinzmann, 1995]. Zwiększone ilości enzymu występują w tkankach nowotworowych, takich jak rak płuc [Butler i in., 1998], rak żołądka [Nomura i in., 1995], rak piersi, głowy i szyi [Okada i in., 1995].
MT1-MMP jest aktywowany przez usunięcie jego prodomeny. Reakcja ta jest katalizowana przez furynę, proteazę serynową typu subtilizyny, która rozpoznaje motyw czterech zasadowych reszt aminokwasowych zlokalizowanych pomiędzy pro-domeną a domeną katalityczną [Pei & Weiss, 1996].
MT1-MMP aktywuje progelatynazę A [Sato et al., Strongin et al., 1995; Will et al., 1996] i prokolagenazę-3 [Knauper et al., 1996] poprzez proteolityczne rozszczepienie ich domen. Zdolność MT1-MMP do aktywacji innych metaloproteinaz macierzy zapewnia potencjał do zwiększonej proteolizy okołokomórkowej w procesach fizjologicznych i patologicznych. W szczególności uważa się, że aktywacja progelatynazy A przez MT1-MMP przyczynia się do lokalnej degradacji macierzy zewnątrzkomórkowej podczas migracji i proliferacji komórek. MT1-MMP hydrolizuje również kolageny fibrylarne I, II i III do charakterystycznych fragmentów ¾ i ¼ [D′Ortho i in., 1997; Ohuci i in..., 1997] i rozszczepia szereg innych białek ECM, w tym fibronektynę, witronektynę, lamininę-1 i proteoglikan siarczanu dermatanu [D′Ortho et al., 1997; Pei & Weiss, 1996; Ohuci et al., 1997]. Aktywność MT1-MMP jest słabo hamowana przez TIMP-1, ale skutecznie hamowana przez TIMP-2 i TIMP-3 [Will i in., 1996].
MT1-MMP ulega ekspresji w dorosłych płucach, łożysku, nerkach, jajnikach, jelitach, prostacie i śledzionie [Will & Hinzmann, 1995]. Zwiększone ilości enzymu występują w tkankach nowotworowych, takich jak rak płuc [Butler i in., 1998], rak żołądka [Nomura i in., 1995], rak piersi, głowy i szyi [Okada i in., 1995].
MT1-MMP jest aktywowany przez usunięcie jego prodomeny. Reakcja ta jest katalizowana przez furynę, proteazę serynową typu subtilizyny, która rozpoznaje motyw czterech zasadowych reszt aminokwasowych zlokalizowanych pomiędzy pro-domeną a domeną katalityczną [Pei & Weiss, 1996].
MT1-MMP aktywuje progelatynazę A [Sato et al., Strongin et al., 1995; Will et al., 1996] i prokolagenazę-3 [Knauper et al., 1996] poprzez proteolityczne rozszczepienie ich domen. Zdolność MT1-MMP do aktywacji innych metaloproteinaz macierzy zapewnia potencjał do zwiększonej proteolizy okołokomórkowej w procesach fizjologicznych i patologicznych. W szczególności uważa się, że aktywacja progelatynazy A przez MT1-MMP przyczynia się do lokalnej degradacji macierzy zewnątrzkomórkowej podczas migracji i proliferacji komórek. MT1-MMP hydrolizuje również kolageny fibrylarne I, II i III do charakterystycznych fragmentów ¾ i ¼ [D′Ortho i in., 1997; Ohuci i in..., 1997] i rozszczepia szereg innych białek ECM, w tym fibronektynę, witronektynę, lamininę-1 i proteoglikan siarczanu dermatanu [D′Ortho et al., 1997; Pei & Weiss, 1996; Ohuci et al., 1997]. Aktywność MT1-MMP jest słabo hamowana przez TIMP-1, ale skutecznie hamowana przez TIMP-2 i TIMP-3 [Will i in., 1996].
Zastosowanie
Przydatny jako standard antygenu w testach immunologicznych. Proenzym może być aktywowany śladowymi ilościami domeny katalitycznej MT1-MMP (D′Ortho i in., 1997; Butler i in., 1998).
Postać fizyczna
Dostarczany jako płyn w 50 mM Tris-HCl, pH 7,5, 150 mM NaCl, 5 mM CaCl2.
Przechowywanie i stabilność
Przechowywać w stanie zamrożonym w temperaturze -70°C w nierozcieńczonych porcjach. Enzym może być przechowywany w temperaturze -20°C przez kilka tygodni. Należy unikać wielokrotnego zamrażania i rozmrażania
Komentarz do analizy
Pojawia się jako dominujące pasmo przy 58 kDa w SDS-PAGE
Informacje prawne
CHEMICON is a registered trademark of Merck KGaA, Darmstadt, Germany
Oświadczenie o zrzeczeniu się odpowiedzialności
Unless otherwise stated in our catalog or other company documentation accompanying the product(s), our products are intended for research use only and are not to be used for any other purpose, which includes but is not limited to, unauthorized commercial uses, in vitro diagnostic uses, ex vivo or in vivo therapeutic uses or any type of consumption or application to humans or animals.
Ta strona może zawierać tekst przetłumaczony maszynowo.
Kod klasy składowania
12 - Non Combustible Liquids
Klasa zagrożenia wodnego (WGK)
WGK 1
Temperatura zapłonu (°F)
Not applicable
Temperatura zapłonu (°C)
Not applicable
Certyfikaty analizy (CoA)
Poszukaj Certyfikaty analizy (CoA), wpisując numer partii/serii produktów. Numery serii i partii można znaleźć na etykiecie produktu po słowach „seria” lub „partia”.
Masz już ten produkt?
Dokumenty związane z niedawno zakupionymi produktami zostały zamieszczone w Bibliotece dokumentów.
H Will et al.
The Journal of biological chemistry, 271(29), 17119-17123 (1996-07-19)
It has been proposed that the cell-mediated activation of progelatinase A requires binding of the C-terminal domain of the proenzyme to a membrane-associated complex of the membrane type matrix metalloproteinase MT1-MMP and TIMP-2. Subsequent sequential proteolysis of the propeptide by
H Sato et al.
Nature, 370(6484), 61-65 (1994-07-07)
Gelatinase A (type-IV collagenase; M(r) 72,000) is produced by tumour stroma cells and is believed to be crucial for their invasion and metastasis, acting by degrading extracellular matrix macro-molecules such as type IV collagen. An inactive precursor of gelatinase A
Membrane type 1 matrix metalloproteinase digests interstitial collagens and other extracellular matrix macromolecules.
Ohuchi, E, et al.
The Journal of Biological Chemistry, 272, 2446-2451 (1997)
Cardiac restricted overexpression of membrane type-1 matrix metalloproteinase causes adverse myocardial remodeling following myocardial infarction.
Spinale, FG; Mukherjee, R; Zavadzkas, JA; Koval, CN; Bouges, S; Stroud, RE; Dobrucki et al.
The Journal of Biological Chemistry null
Lisa M Hodgkinson et al.
Investigative ophthalmology & visual science, 48(9), 4192-4199 (2007-08-29)
Matrix metalloproteinases (MMPs) and the tissue inhibitors of the MMPs (TIMPs) have been implicated in lens differentiation, growth, remodeling, and cataract. Hence, a gene expression analysis was undertaken in epithelial and fiber cells dissected from clear human donor lenses. The
Nasz zespół naukowców ma doświadczenie we wszystkich obszarach badań, w tym w naukach przyrodniczych, materiałoznawstwie, syntezie chemicznej, chromatografii, analityce i wielu innych dziedzinach.
Skontaktuj się z zespołem ds. pomocy technicznej