ポリ(エチレングリコール)をベースとする防汚性の生体模倣型グラフトポリマー被膜
Lesley M. Hamming, Prof. Phillip B. Messersmith
Biomedical Engineering Department, Northwestern University Evanston, IL
Material Matters 2008, Vol.3 No.3
天然材料や人工材料が使用されている環境ではほぼ例外なく、表面への生物学的物質の蓄積が避けられません。生体分子や生物が表面に付着したとしてもほとんど影響を及ぼさないこともありますが、デバイスと構造の性能や安全性を維持するには、生物付着を最小限に抑えるか制御する必要があります。たとえば、医学的環境では、タンパク質、細胞、病原体といった生体液の成分が表面に強力に付着しやすく、そのために性能が変化して危険な結果をもたらすおそれがあります。カテーテルに微生物がコロニー形成することによって引き起こされる尿路感染は、最も頻度の高い院内感染です1。また、植込み型医療器具も微生物腐食(MIC:microbially influenced corrosion)に弱く、置換手術が必要となり感染のリスクが増大します2。この他に生物付着を起こしやすい表面としては船体が挙げられます。海洋生物やその分泌物で覆われることによって、推進効率が低下し、燃費の低下を引き起こします3。本稿では、表面にポリマーを結合させる生体模倣の方法をはじめとした、ポリマーをグラフトすることによって表面への生物付着を防ぐ方法を簡単に紹介します。
生物付着を防ぐ一般的な方法は、図1に示すように表面への防汚性ポリマーのグラフト化です4。このようなグラフトさせたポリマーシステムの重要な点は、防汚性ポリマーの化学的特性、分子量および構造のほか、表面にポリマーをグラフトさせる方法にあります。最も広範に検討されている防汚性ポリマーのひとつにポリ(エチレングリコール)(PEG)がありますが、PEGは医薬品や薬物送達に昔から用いられている毒性の低い水溶性ポリマーです5。大学や企業の研究者は、直接合成したり購入することでPEGを入手することができます。そしてそのPEGに適切な化学的誘導体化を行って表面にグラフトさせると、タンパク質、細胞、細菌の非特異的な吸着を抑制することができます。PEGを固定化した表面がタンパク質や細胞の吸着を抑制する熱力学的メカニズムや分子メカニズムは完全には解明されていませんが、数々の研究によって、グラフトされたポリマーの立体障害効果、鎖長、グラフト密度、鎖の立体配座、親水性がタンパク質の付着を予防する重要な役割を果たしていることが確認されています6-8。
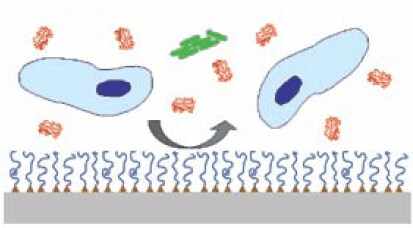
図1基板(灰色)の特定の官能基(三角)に防汚性ポリマー(青線)を固定したグラフト化防汚性ポリマーシステムの図。ポリマーがタンパク質(赤)、細胞(青)、細菌(緑)の表面吸着を阻む物理的な障壁になります。
防汚性ポリマーは、ふたつの基本的な方法で表面にグラフトさせることができます。graft-to法では、アンカー基を導入したポリマーをあらかじめ合成し、これを表面に吸着させます。対照的に、graft-from法ではグラフト化した開始剤から直接ポリマーを伸張させます。graft-to系は膜厚が通常単分子層レベル(数ナノメートル)であり、溶媒からポリマーを物理吸着または化学吸着させて形成させます。graft-from系の場合、膜厚がはるかに厚いものの(10~100ナノメートル以上)、適切な開始剤で基板をあらかじめ修飾する必要があります。しかし、いずれの方法を用いるにも、物理吸着または化学吸着による相互作用でポリマーを表面に固定できることが不可欠となります。物理吸着では比較的弱いファンデルワールス力や疎水性の力によってポリマーが表面に結びつけられており、その例としてプルロニック型ブロック共重合体の疎水性基材への吸着が挙げられます9。化学吸着では、通常、ポリマーの基材への結合がさらに強固であり、その例として金-チオラート10、金属酸化物-シラン結合11、静電的相互作用12が挙げられます。
近年、生物の利用している方法をヒントにすることで、ポリマーを表面にグラフトさせる新たな方法を見出すようになっています。特に興味深いのは海洋接着タンパク質に存在する特異なアミノ酸で、湿った表面への安定かつ強固な結合に利用されています。イガイ類は、湿った環境や乱流の環境の中でも岩、木、動物、貝殻といったさまざまな材料の表面に強く接着します。この貝の足糸の先端粘膜円盤と基板との接触面付近に存在するタンパク質中には、アミノ酸3,4-ジヒドロキシフェニルアラニン(DOPA)が最大27 mol%の濃度で存在します(図2)13。原子間力顕微鏡による単分子レベルの強度測定によって示されたように14、DOPAは優れた接着性をもたらし、有機物表面や無機物表面と強力な化学的相互作用を形成します。
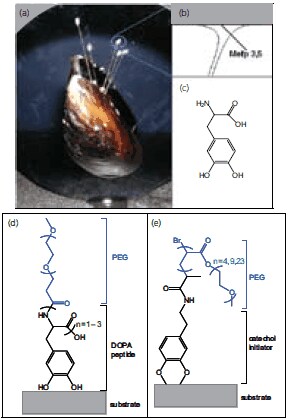
図2生体をヒントにした防汚性ポリマーを表面にグラフトする方法。(a)基材に接着した貝の画像、(b)アミノ酸3,4-ジヒドロキシフェニルアラニン(DOPA)の含有量が最も多いイガイ類の接着タンパク質(Mefp-3,Mefp-5)の界面部と足糸の先端粘膜円盤の図、(c)DOPAの化学構造、(d)アンカー部分の接着ペプチドと防汚性PEGポリマーを示したgraft-to生体模倣型ポリマーの例(e)表面に結合した生体模倣型開始剤と重合化PEGポリマーを示したgraft-from生体模倣型ポリマーの例
最近、防汚性ポリマーを表面に結合させるさまざまな方法にDOPAの化学的多用性と堅牢性が利用されています15。DOPA含有ペプチドを結合させた末端モノメトキシ化PEGなどのポリマーは、PEGの優れた防汚性と、graft-to法によって簡単に結合させることができる接着性のアンカーを兼ね備えています16。1~3個のDOPA残基を使って誘導体化した鎖状PEGポリマー(図2)は、酸化チタン(TiO2)基板や金基板に吸着することが見出され17、光導波路分光法(OWLS:optical waveguide spectroscopy)と分光エリプソメトリー(ELM:spectroscopic ellipsometry)で測定されたように血清成分に対する優れた防汚性を示しました。血清のin-situ吸着から、対照試料のTiO2表面には250 ng/cm2の血清タンパク質が蓄積していたのに対して、mPEG-DOPA3で修飾したTiO2表面に蓄積していた血清タンパク質はわずか1 ng/cm2未満であることがわかり、DOPAを結合させたPEGの優れた防汚性が確認されました17。さらに高性能なペプチドアンカーも開発されており、たとえば、ムラサキイガイのfoot protein-1のデカペプチド類縁体をPEGに結合させ、これを用いて金表面に細胞接着防止機能を付与しています(図3)16。ペプチドを結合させたポリマーの合成は、厳密なアミノ酸の配列を求める場合は固相法を利用し、特に厳密なアミノ酸配列を必要としないペプチドオリゴマーアンカーを合成する場合はモノアミンを導入したポリマーを開始点としてN-カルボキシ無水物モノマーを重合させます。最近、生物学的な鉄キレート物質であるanachelinからヒントを得て、カテコールを基盤とする接着性のアンカーを同様に用いたところ18、表面にPEGを結合させる際に用いることのできるアンカー基の種類を大幅に増やすことができました。
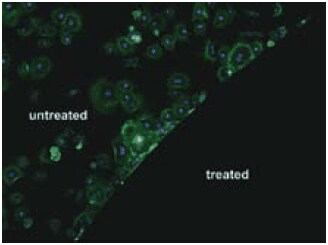
図3未処理の金(左上)と、イガイ類接着タンパク質類縁体のデカペプチドAla-Lys-Pro-Ser-Tyr-Hyp-Hyp-Thr-DOPA-Lysで誘導体化したPEGをグラフトした金(右下)への繊維芽細胞の接着
graft-from法も防汚性被膜の作製に利用されており、表面に結合した開始剤からPEGマクロモノマーを重合させる方法がとられています。例えば、開始剤を連結させた自己組織化単分子層(SAM:self assembled monolayer)で改質した金表面から、原子移動ラジカル重合(ATRP:atom transfer radical polymerization)を利用してアクリレートで修飾したPEGを重合させています19。得られたグラフトポリマー被膜は、このほかの大抵のgraft-from被膜と同じようにgraft-to被膜よりもはるかに厚く、タンパク質や細胞の付着を防止する優れた効果を有しています。生体模倣型アンカーに関してはドーパミンをベースとするATRP開始剤が合成され、金属酸化物表面に防汚性被膜が調製されています20。この場合、DOPAの側鎖にあるカテコール残基を使って酸化チタンやステンレス鋼表面に吸着させ、ここからATRPを介してPEGマクロモノマーを重合し、厚みのある防汚性被膜が得られています。
最近、防汚性ポリマーでさまざまな材料を修飾できるきわめて汎用性の高いハイブリッド型graft-from/graft-to法が報告されています21。この方法は2段階であり、最初の段階ではアルカリ性条件下でドーパミン塩酸塩を重合させる方法を利用します。この方法で、ほぼすべての材料表面に薄い(50 nm以下)接着性ポリドーパミン被膜を作製できます。この被膜加工は容易に入手できる材料を使用して簡便なディップコーティングを利用しているため、複雑な形状物にも行うことができます。ポリドーパミン被膜の作製に利用する反応は、イガイ類接着タンパク質の固化やメラニン色素の生成の際に起こる反応とよく似ています。得られる被膜は求核剤に対して潜在的な反応性を有しており、アミンやチオールを導入したPEGを、ポリドーパミンで被覆した表面に共有結合でグラフトする次のステップに好都合です(図4)。この新しい材料改質法は、面倒な表面作製段階を必要とせず、graft-from(1段階目)法とgraft-to(2段階目)法の二つのステップによるものであり、表面に防汚性を付与する簡便で経済的な汎用性の高い方法となるでしょう。
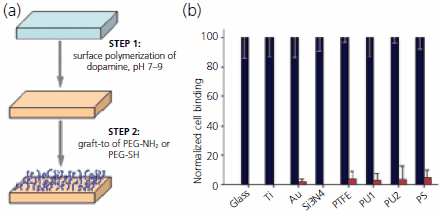
図4二段階の方法で基板表面に防汚性ポリマーをグラフトさせる簡便な手法。(a)基板表面にてドーパミンを重合させたのちに、アミンまたはチオールを有するPEGを結合させる表面グラフト法の模式図。この方法を用いることによって、無機材料や有機材料をはじめとするさまざまな表面にPEGをグラフトした防汚性被膜を作製することができます。(b)ポリドーパミンとPEG-NH2による各種基板の改質前(黒のバー)と改質後(赤のバー)の細胞接着を標準化したグラフ。ガラス、チタン、金、窒化ケイ素、テフロン(PTFE)、ポリウレタン(PU1、PU2)、ポリスチレン(PS)をそれぞれ表しています。
PEGをグラフトした被膜を利用した、表面への海洋生物の付着阻害についても検討されていて22-24、超分岐フルオロポリマー-PEG複合材料22、側鎖にPEGを有する疎水性ポリマー23、鎖状PEG24といったさまざまなデザインのグラフトポリマーが使用されています。これらの研究では現在まで珪藻(Navicula perminuta)と緑藻類(Ulva linza)の付着に焦点が当てられており、PEG含有量の増大に応じて防汚性能が向上し、標準的なシリコーン系防汚コーティングよりも優れた性能を示します。現在、シリコーン系防汚コーティングは生物付着物の流体力学的な除去のするために水産業で利用されていますが、このコーティングはあらゆる海洋生物付着に対して完全に有効というわけではなく、速度の遅い船舶ではあまり効果を発揮しません。さらに開発を進めることによって、PEGをベースとするコーティングは海洋環境で高い防汚性能を発揮する可能性があります。
以上をまとめると、PEGをグラフトした被膜はタンパク質、細胞、細菌、このほかの生物の付着を効果的に防ぐことができます。生物からヒントを得たアンカー部分によって、PEGを表面に結合させる簡便、多用途かつ確実な方法が見出されました。このPEG被膜を使って植込み型医療器具、コンタクトレンズ、外科用器具、バイオセンサー、バイオセパレーション向けの電気泳動用キャピラリーのほか、付着を起こしやすい水処理設備や船体の表面への付着をコントロールすることができます。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?