93615
Tripsina
~1500 U/mg
Autenticatiper visualizzare i prezzi riservati alla tua organizzazione & contrattuali
About This Item
Prodotti consigliati
Stato
powder
Attività specifica
~1500 U/mg
PM
23.8 kDa
Attività estranea
chymotrypsin ≤0.1%
Temperatura di conservazione
2-8°C
Cerchi prodotti simili? Visita Guida al confronto tra prodotti
Categorie correlate
Applicazioni
Per la digestione dei peptidi con tripsina, utilizzare un rapporto di circa 1:100-1:20 tra tripsina e peptide. L′uso tipico di questo prodotto è nella rimozione delle cellule aderenti dalla superficie di una coltura. La concentrazione di tripsina necessaria ad allontanare le cellule dal loro substrato dipende in primo luogo dal tipo cellulare e dall′età della coltura. Le tripsine sono state usate anche per risospendere le cellule durante la coltura, nella ricerca proteomica per la digestione delle proteine e in diverse digestioni tramite gel†. Ulteriori applicazioni includono la valutazione della cristallizzazione per mezzo di tecniche basate sulle membrane e in uno studio per accertare che la presenza di trappole cinetiche può limitare i tassi di ripiegamento e le rese delle proteine.
Azioni biochim/fisiol
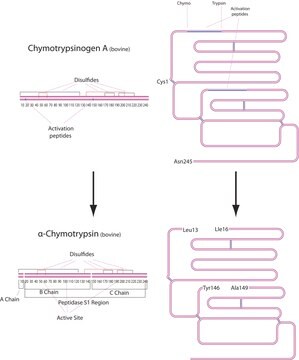
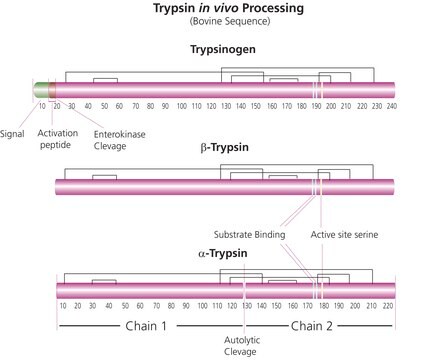
La tripsina scinde i peptidi dall′estremità C-terminale dei residui della lisina e dell′arginina. Se su una o l′altra estremità del sito di scissione vi è un residuo acido, la velocità dell′idrolisi della reazione si riduce, mentre la presenza di un residuo di prolina sull′estremità carbossilica del sito di scissione interrompe l′idrolisi. Il pH ottimale per l′attività della tripsina è tra 7 e 9. La tripsina è anche in grado di scindere i legami esteri e ammidici dei derivati sintetici degli aminoacidi. Alle soluzioni di tripsina si aggiunge EDTA come agente chelante che neutralizza gli ioni calcio e magnesio che coprono i legami peptidici su cui agisce la tripsina. La rimozione di questi ioni aumenta l′attività enzimatica.
Gli inibitori delle serin proteasi, inclusi tra gli altri DFP, TLCK, APMSF, AEBSEF e aprotina inibiranno la tripsina
Gli inibitori delle serin proteasi, inclusi tra gli altri DFP, TLCK, APMSF, AEBSEF e aprotina inibiranno la tripsina
Definizione di unità
Una unità BAEE produrrà un ΔA253 di 0,001 per minuto a pH 7,6 a 25 °C, usando BAEE come substrato. Una unità BTEE = 320 unità ATEE. Volume della reazione = 3,2 mL (1 cm via luminosa).
1 U corresponds to the amount of enzyme which increases the absorbance at 253 nm by 0.001 per minute at pH 7.6 and 25°C (N-benzoyl-L-arginine ethyl ester, Cat. No. 12880, as substrate)
Altre note
Sales restrictions may apply
Avvertenze
Danger
Indicazioni di pericolo
Consigli di prudenza
Classi di pericolo
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
Organi bersaglio
Respiratory system
Codice della classe di stoccaggio
11 - Combustible Solids
Classe di pericolosità dell'acqua (WGK)
WGK 1
Dispositivi di protezione individuale
dust mask type N95 (US), Eyeshields, Faceshields, Gloves
Scegli una delle versioni più recenti:
Possiedi già questo prodotto?
I documenti relativi ai prodotti acquistati recentemente sono disponibili nell’Archivio dei documenti.
I clienti hanno visto anche
Peter Halasz et al.
Journal of virology, 82(1), 148-160 (2007-10-19)
Changes in the interactions between intestinal cells and their surrounding environment during virus infection have not been well documented. The growth and survival of intestinal epithelial cells, the main targets of rotavirus infection, are largely dependent on the interaction of
Olivier Rivoire
Physical review letters, 110(17), 178102-178102 (2013-05-18)
Studies of coevolution of amino acids within and between proteins have revealed two types of coevolving units: coevolving contacts, which are pairs of amino acids distant along the sequence but in contact in the three-dimensional structure, and sectors, which are
Mian Zhou et al.
Nature, 495(7439), 111-115 (2013-02-19)
Codon-usage bias has been observed in almost all genomes and is thought to result from selection for efficient and accurate translation of highly expressed genes. Codon usage is also implicated in the control of transcription, splicing and RNA structure. Many
Janina Boyken et al.
Neuron, 78(2), 285-297 (2013-04-30)
Neurotransmission involves calcium-triggered fusion of docked synaptic vesicles at specialized presynaptic release sites. While many of the participating proteins have been identified, the molecular composition of these sites has not been characterized comprehensively. Here, we report a procedure to biochemically
Paul P Geurink et al.
Journal of medicinal chemistry, 56(3), 1262-1275 (2013-01-17)
Proteasomes degrade the majority of proteins in mammalian cells by a concerted action of three distinct pairs of active sites. The chymotrypsin-like sites are targets of antimyeloma agents bortezomib and carfilzomib. Inhibitors of the trypsin-like site sensitize multiple myeloma cells
Il team dei nostri ricercatori vanta grande esperienza in tutte le aree della ricerca quali Life Science, scienza dei materiali, sintesi chimica, cromatografia, discipline analitiche, ecc..
Contatta l'Assistenza Tecnica.