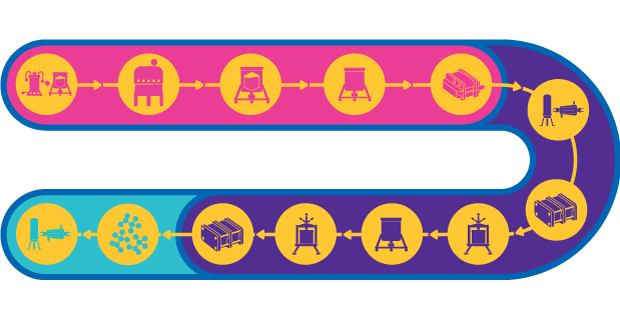
Production de vaccins à pseudoparticules virales (PPV)
Les pseudoparticules virales (PPV ou VLP en anglais pour "virus-like particles") reproduisent la structure générale des particules virales sans toutefois contenir de matériel génétique infectieux. Lorsqu'elles sont utilisées comme vaccin, les PPV provoquent une réponse immunogène robuste en raison de leur présentation d'épitopes de grande densité et de leur capacité à présenter un grand nombre de protéines au système immunitaire.
La fabrication de PPV nécessite l'expression, par une cellule, de la protéine d'enveloppe virale. Les pseudoparticules virales peuvent être exprimées dans plusieurs systèmes d'expression hétérologue, impliquant notamment la culture de cellules de mammifères, la culture de cellules d'insectes/de baculovirus, une fermentation microbienne ou des plantes. Soit les PPV sont assemblées in vivo puis extraites du lysat cellulaire et purifiées, soit la protéine partiellement assemblée est extraite du lysat cellulaire puis assemblée in vitro jusqu'à former les PPV.
Ressources apparentées
Biopharmaceutical Applications Guide
Article technique : Choosing the optimal cell culture media for vaccine production
Article technique : Choosing the Optimal Vaccine Adjuvant
Article : How a Global Network Is Developing a Virus-Like-Particle Vaccine Against Covid-19
Article : The Role of the Virus-Like Particle Vaccine Technology in the Evolving Pandemic
Communiqué de presse : Collaboration with Innovative Biotech to Support Establishment of First Vaccine Production Facility in Nigeria
Webinaire : Sf-RVN Cell Line and CD Media Platform, A Production Platform for VLP and AAV
Webinaire : Insights from a Global Collaboration Accelerating Vaccine Development with an Optimized VLP Platform
Brochure : Vaccine Bioprocessing Handbook
Mini-guide : VLPs Vaccine Bioprocessing
Livre blanc : Sf-RVN® Insect Cell Line for Your Vaccine Processes
Article : Nucleic Acid Impurity Reduction in Viral Vaccine Manufacturing
Article : Filter-Based Clarification of Viral Vaccines and Vectors
Optimiser la productivité et la clarification upstream avec une transposition d'échelle fiable
La plateforme de production upstream choisie pour la production des PPV doit être optimisée pour respecter les objectifs de productivité. Cette optimisation inclut l'étape de clarification qui fait suite à la lyse cellulaire et qui vise à retirer les cellules et les débris cellulaires. Elle permet de garantir une récolte robuste des particules. Le procédé upstream n'est toutefois concluant que s'il peut être transposé de manière fiable et de façon à répondre aux prévisions de la demande du marché.
Atteindre les objectifs de rendement et d'efficacité avec une élimination robuste des impuretés
Les acides nucléiques provenant des cellules lysées sont un contaminant courant des procédés de production de PPV. L'Agence européenne des médicaments (EMA) et l'Organisation mondiale de la santé (OMS) ont fixé comme limites admissibles 10 ng d'ADN par dose pour les vaccins administrés par voie parentérale et 100 µg d'ADN par dose pour les vaccins administrés par voie orale. De plus, afin de réduire au minimum le risque d'oncogénicité des acides nucléiques issus des cellules hôtes, la longueur de l'ADN doit être réduite à 100–200 paires de bases.
Maximiser la quantité de produit récupéré en aval
Les PPV sont généralement purifiées par ultracentrifugation. Même si ce procédé est bien établi pour la production à petite échelle, il peut être chronophage et peu transposable à grande échelle. Les méthodes de purification telles que la chromatographie d'échange d'ions peuvent constituer une alternative. Pour certains procédés, l'adsorption sur membrane et la technologie monolithique peuvent donner une meilleure capacité de liaison dynamique (DBC) que les résines particulaires. Les résines multimodales qui fonctionnent par exclusion stérique et par séparation via des liaisons sont une autre option.
Garantir la sécurité des patients avec une filtration, une formulation et un remplissage final stériles
Pour garantir la sécurité des patients, le produit à base de PPV final doit être stérilisé par filtration avec un filtre de 0,22 µm. La formulation d'un vaccin à base de PPV peut se faire avec des éléments à usage unique ; des sacs à usage unique contenant les réactifs destinés à la formulation peuvent être reliés à n'importe quel agitateur via des raccords à connexion rapide stériles. Une fois le mélange et la formulation terminés, le produit peut être transféré en conditions aseptiques vers des systèmes de remplissage à usage unique pour les étapes finales du conditionnement et de la mise en flacon.

Culture cellulaire upstream
Maximisez la productivité upstream de vos PPV et assurez un transfert d'échelle robuste :
- Culture cellulaire avec CellPrime® rTrypsin
- Milieu pour cellules d'insectes EX-CELL® CD
- Culture cellulaire avec les bioréacteurs à usage unique Mobius®
- Filtration des virus avec le micro-kit de mise au point de procédé Viresolve Barrier
- Prélèvement stérile avec le système d'échantillonnage stérile NovaSeptum® GO
Traitement avec des nucléases et clarification
Atteignez votre rendement cible pour les PPV et l'efficacité opérationnelle recherchée tout en garantissant une élimination robuste des impuretés :
- Traitement par la nucléase Benzonase® pour la production biopharmaceutique EMPROVE® bio
- Détection Benzonase® avec le kit Elisa II Benzonase® permettant de détecter l'endonucléase Benzonase® résiduelle dans le procédé
- Clarification primaire/secondaire avec les filtres en profondeur Millistak+® HC POD
- Clarification primaire avec les filtres en profondeur Clarisolve®
- Clarification secondaire avec les cartouches Polysep II

Filtration tangentielle downstream
Atteignez vos objectifs de rendement, d'efficacité et de quantité de virus récupéré tout en garantissant une élimination robuste des impuretés :
Chromatographie downstream
- Chromatographie sur membrane avec la résine Eshmuno® Q
- Chromatographie sur membrane avec les membranes de chromatographie Natrix® Q Recon Mini
- Chromatographie sur membrane avec la membrane de chromatographie Natrix® Q Pilot
- Chromatographie de capture et/ou de polissage avec les résines de chromatographie Fractogel® EMD DEAE
- Chromatographie de capture et/ou de polissage avec les résines de chromatographie Fractogel® EMD DMAE

Produits chimiques industriels et formulation
Filtration stérilisante finale et remplissage final
Garantissez la sécurité des patients avec une filtration stérilisante, une formulation et un remplissage final robustes et fiables :
- Filtration stérilisante finale et remplissage final
- Filtres Durapore® de 0,22 µm
- Filtres Millipore Express® SHF ("Sterile, High Flux")
- Prélèvement stérile avec les solutions d'échantillonnage stérile NovaSeptum® Go
- Remplissage-finition avec les solutions de remplissage-finition à usage unique Mobius®
- Stratégies de filtration stérilisante
- Stratégies de remplissage final

Services de validation et d'analyse
Nos services d'analyse BioReliance® proposent des solutions exceptionnelles qui permettent d'atténuer les risques, pour vous aider à lancer plus rapidement sur le marché des médicaments qui sauveront des vies :
Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?