Descrição geral
A colagenase é uma protease que cliva a proteína em tripla-hélice chamada colágeno. Há três tipos de colagenases teciduais e estas pertencem à família das metaloproteinases de matriz (MMP). A colagenase obtida do Clostridium histolyticum tem uma atividade muito potente, pois digere colágeno de ambas as terminações, em temperaturas tão baixas quanto 4 ºC-10 °C. Misturas de colágeno brutas contêm duas enzimas principais, a saber colagenase e clostripain.
Aplicação
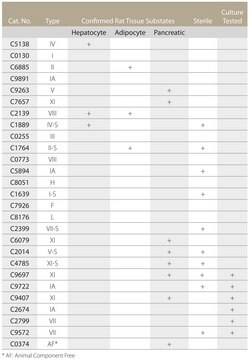
A colagenase de Clostridium histolyticum é amplamente usada em estudos biológicos, onde é usada para preparar suspensões de células isoladas. Este produto é adequado para desagregação de tumor humano, rins de camundongo, cérebro de adultos e fetal humano, pulmão e vários outros tecidos epiteliais. Demonstrou-se também que é eficaz em estudos de perfusão de fígado e rim, digestão de pâncreas e isolamento de células de fígado de rato não parenquimais e preparo de hepatócitos. A colagenase foi usada também no preparo de tecido arterial para o estudo de produtos finais da glicosilação avançada. Esta enzima foi testada para a liberação de hepatócitos em uma concentração de cerca de 1 mg/ml. Concentrações para o intervalo de digestão de 0,1 a 5 mg/ml.
Ações bioquímicas/fisiológicas
O produto da colagenase é uma mistura de enzimas secretada por C. histolyticum, com diferentes produtos diferenciados pelas proporções relativas de 10-18 componentes encontrados nas enzimas secretadas. Os principais componentes são duas colagenases, clostripain e uma protease neutra. A ação sinergística dessas enzimas degrada o colágeno e outros materiais intracelulares. A ação das enzimas colagenases e da protease neutra é necessária para liberação eficaz das células do tecido. Vários tipos de colágenos são substratos naturais da colagenase.
A colagenase é ativada por quatro gramas de átomos de cálcio por mol de enzima. Ela é inibida por ácido etileno glicol-bis(beta-aminoetil éter)-N, N, N′,N′-tetracético, beta-mercaptoetanol, glutationa, ácido tioglicólico e 8-hidroxiquinolina.
Atenção
Na forma fornecida, este produto é estável por um ano a -20 °C. Não há perda de FALGPA ou atividade de proteases em 30 dias a 37 °C, 50 °C e -20 °C. Soluções de colagenase bruta são estáveis se congeladas rapidamente em alíquotas (em concentração de 10 mg/ml) e mantidas congeladas a -20 °C. Ciclos adicionais de congelamento e descongelamento danificarão a solução. O produto retém 100% de atividade ao longo de 7 horas se mantido em gelo.
Definição da unidade
Uma unidade de digestão de colágeno (CDU) libera peptídeos de colágeno do tendão de Aquiles bovino que equivalem em cor de ninidrina a 1,0 μmol de leucina em 5 horas em pH 7,4 a 37 °C na presença de íons de cálcio. Uma unidade de hidrólise de FALGPA hidrolisa 1,0 μmol de furilacriloil-Leu-Gli-Pro-Ala por min a 25 °C. Uma unidade de protease neutra hidrolisa caseína para produzir cor equivalente a 1,0 μmol de tirosina por 5 h em pH 7,5 a 37 °C. Uma unidade de clostripaína hidrolisa 1,0 μmol de BAEE por min em pH 7,6 a 25 °C na presença de DTT.
Nota de preparo
Este produto é equivalente à primeira fração de sulfato de amônio de 40% de Mandl, I., et al., J. Clin. Invest., 32, 1323 (1953). As soluções são preparadas tipicamente em concentração de 1-2 mg/ml em tampão TESCA (contendo 50 mM de TES, 0,36 mM de cloreto de cálcio, pH 7,4, a 37 °C).