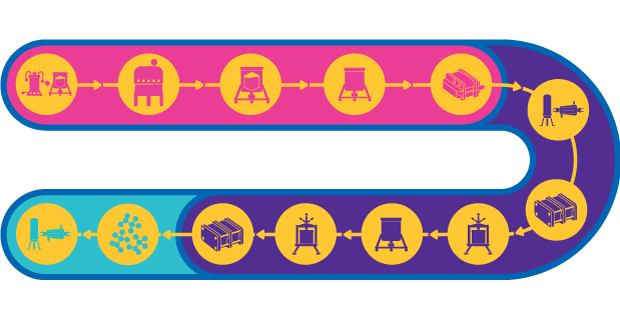
Virusähnliche Partikel (VLP) für die Impfstoffherstellung
Virusähnliche Partikel (VLP) ahmen die Gesamtstruktur von Viruspartikeln nach, enthalten aber nicht das infektiöse genetische Material. Bei der Verwendung als Impfstoff verursachen VLP eine robuste immunogene Reaktion, da sie Epitope in hoher Dichte darstellen und dem Immunsystem mehrere Proteine präsentieren können.
Die Herstellung von VLP erfordert die zellbasierte Expression des Virushüllenproteins. VLP können in verschiedenen heterologen Expressionssystemen exprimiert werden, darunter Säugerzellkulturen, Baculovirus-/Insektenzellkultursysteme, mikrobielle Fermentation und Pflanzen. VLP werden entweder in vivo assembliert und anschließend aus Zelllysat aufgereinigt oder das teilweise assemblierte Protein wird aus Zelllysat gewonnen und in vitro zu VLP assembliert.
Weitere Informationsquellen
Biopharmaceutical Applications Guide
Technischer Artikel: Choosing the optimal cell culture media for vaccine production
Technischer Artikel: Choosing the Optimal Vaccine Adjuvant
Artikel: How a Global Network Is Developing a Virus-Like-Particle Vaccine Against Covid-19
Artikel: The Role of the Virus-Like Particle Vaccine Technology in the Evolving Pandemic
Pressemitteilung: Collaboration with Innovative Biotech to Support Establishment of First Vaccine Production Facility in Nigeria
Webinar: Sf-RVN Cell Line and CD Media Platform: A Production Platform for VLP and AAV
Webinar: Insights from a Global Collaboration Accelerating Vaccine Development with an Optimized VLP Platform
Broschüre: Vaccine Bioprocessing Handbook
Mini-Handbuch: VLPs Vaccine Bioprocessing
Whitepaper: Sf-RVN® Insect Cell Line for Your Vaccine Processes
Artikel: Nucleic Acid Impurity Reduction in Viral Vaccine Manufacturing
Artikel: Filter-Based Clarification of Viral Vaccines and Vectors
Optimierung der vorgelagerten Produktivität und Klärfiltration durch zuverlässige Skalierung
Die für die Herstellung von VLP gewählte vorgelagerte Produktionsplattform muss optimiert werden, um die Produktivitätsanforderungen zu erfüllen. Diese Optimierung umfasst den Klärfiltrationsschritt, der auf die Zelllyse folgt, um Zellen und Zelltrümmer zu entfernen und eine robuste Partikelernte zu gewährleisten. Der vorgelagerte Prozess ist jedoch nur dann erfolgreich, wenn er zuverlässig skaliert werden kann, um damit der antizipierten Marktnachfrage gerecht zu werden.
Erreichen von Ertrags- und Effizienzzielen durch robuste Abscheidung von Verunreinigungen
Nukleinsäuren aus lysierten Zellen sind eine häufig auftretende Verunreinigung in VLP-Verfahren. Die Europäische Arzneimittelagentur (EMA) und die Weltgesundheitsorganisation (WHO) lassen 10 ng DNA pro Dosis für parenterale Impfstoffe und 100 µg DNA pro Dosis für orale Impfstoffe zu. Um das Risiko der Onkogenität von Wirtszellnukleinsäuren zu minimieren, muss die DNA auf eine Länge von 100-200 Basenpaaren reduziert werden.
Maximierung der nachgelagerten Rückgewinnung
VLP werden in der Regel durch Ultrazentrifugation aufgereinigt. Dieses Verfahren hat sich zwar für die Produktion im kleinen Maßstab bewährt, kann aber zeitaufwendig und schlecht skalierbar sein. Als Alternative können Aufreinigungsverfahren wie die Ionenaustauschchromatographie eingesetzt werden. Bei bestimmten Verfahren können die Membranadsorption und die Monolithtechnologie eine bessere dynamische Bindungskapazität (DBC) bieten als Harze auf Partikelbasis. Eine weitere Option sind multimodale Harze, die sowohl den Größenausschluss als auch die auf Bindung basierende Trennung nutzen.
Gewährleistung der Patientensicherheit durch Sterilfiltration, Formulierung und Endabfüllung
Um die Sicherheit der Patienten zu gewährleisten, muss das VLP-Endprodukt mit einem 0,22-µm-Filter steril-gefiltert werden. Die Formulierung von Impfstoffen auf VLP-Basis kann unter Verwendung von Einwegkomponenten erfolgen; Einwegbeutel mit Formulierungsreagenzien können über sterile Schnellanschlüsse an jeden Mischer angeschlossen werden. Nach der Mischung und Formulierung kann das Produkt aseptisch in Einwegabfüllsysteme für die Endabfüllung und das Abfüllen in Fläschchen überführt werden.

Vorgelagerte Zellkultur
Maximieren Sie die vorgelagerte Produktivität von VLP und sorgen Sie für eine robuste Skalierbarkeit durch:
Nuklease-Behandlung & Klärfiltration
Erzielen Sie die gewünschte VLP- und Prozesseffizienzausbeute und stellen Sie gleichzeitig eine robuste Abscheidung von Verunreinigungen sicher durch:
- Nukleasebehandlung mit Benzonase® geeignet für die biopharmazeutische Produktion EMPROVE® bio
- Benzonase® Nachweis mit Benzonase® Elisa-Kit II zum Nachweis von Benzonase® Endonuklease-Resten im Prozess
- Primär-/Sekundär-Klärfiltration mit Millistak+® HC POD-Tiefenfiltern
- Primär-Klärfiltration mit Clarisolve® Tiefenfiltern
- Sekundäre Klärfiltration mit Polysep II-Filterelementen

Downstream - Tangentialflussfiltration
Erreichen Sie Ihre Ziele in Bezug auf Ausbeute, Effizienz und Virusrückgewinnung und gewährleisten Sie gleichzeitig eine zuverlässige Abscheidung von Verunreinigungen durch:
Downstream - Chromatographie
- Membranchromatographie mit Eshmuno® Q Harz
- Membranchromatographie mit Natrix® Q Recon Mini Chromatographiemembranen
- Membranchromatographie mit Natrix® Q Pilot Chromatographiemembran
- Capture- und/oder Polishing-Chromatographie mit Fractogel® EMD DEAE Chromatographieharzen
- Capture- und/oder Polishing-Chromatographie mit Fractogel® EMD DMAE Chromatographieharzen

Endständige Sterilfiltration & Abfüllung
Gewährleistung der Patientensicherheit durch zuverlässige und robuste Sterilfiltration, Formulierung und Endabfüllung.
- Endständige Sterilfiltration & Abfüllung
- Durapore® 0,22 µm Filter
- Millipore Express® SHF Filter (steril, Hochdurchsatz)
- Sterile Probenahme mit NovaSeptum® Go Sterilprobenahmelösungen
- Abfüllung & Fertigstellung mit Mobius® Einweglösungen für die Abfüllung und Fertigstellung
- Strategien für die Sterilfiltration
- Strategien für die Endabfüllung

Validierung & Prüfdienstleistungen
Unsere BioReliance® Prüfdienstleistungen bieten außergewöhnliche, risikomindernde Lösungen, damit Sie schneller lebensverändernde Arzneimittel auf den Markt bringen können.
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?