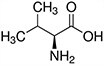
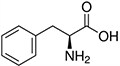
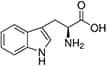
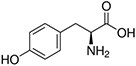
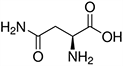
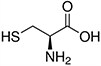
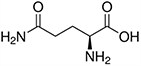
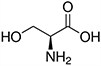
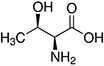
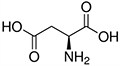
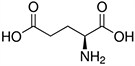
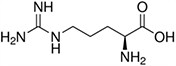
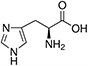
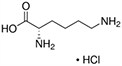
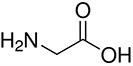
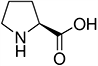
Tabela referencyjna aminokwasów
1 pKa jest ujemną wartością logarytmu stałej dysocjacji dla grupy -COOH.
2 pKb jest ujemną wartością logarytmu stałej dysocjacji dla grupy -NH3
3 pKx jest ujemną wartością logarytmu stałej dysocjacji dla dowolnej innej grupy w cząsteczce.
3 pKx to ujemna część logarytmu stałej dysocjacji dla dowolnej innej grupy w cząsteczce.
4 pl to pH w punkcie izoelektrycznym.
Referencje: D.R. Lide, Handbook of Chemistry and Physics, 72nd Edition, CRC Press, Boca Raton, FL, 1991.
.
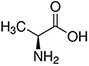
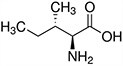
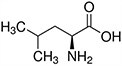
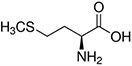
Aminokwasy są związkami lub elementami budulcowymi, które tworzą peptydy i białka. Każdy aminokwas zbudowany jest z grupy aminowej i grupy karboksylowej związanej z czworościennym węglem. Węgiel ten jest określany jako węgiel α (węgiel alfa).
Aminokwasy różnią się od siebie łańcuchami bocznymi, które są określane jako grupy R. Grupa R dla każdego z aminokwasów będzie różnić się strukturą, ładunkiem elektrycznym i polaryzacją.
Odnieś się do poniższych wykresów i struktur, aby poznać właściwości aminokwasów, ich rodzaje, zastosowania i dostępność.
Aminokwasy z hydrofobowym łańcuchem bocznym - alifatyczne
Aminokwasy z hydrofobowym łańcuchem bocznym - aromatyczne
Aminokwasy z polarnymi neutralnymi łańcuchami bocznymi
Aminokwasy z elektrycznie naładowanymi łańcuchami bocznymi - kwaśne
Aminokwasy z elektrycznie naładowanymi łańcuchami bocznymi - podstawowe
Unikalne aminokwasy
Indeks hydrofobowości dla popularnych aminokwasów
Indeks hydrofobowości jest miarą względnej hydrofobowości lub rozpuszczalności aminokwasu w wodzie. W białku aminokwasy hydrofobowe prawdopodobnie znajdują się we wnętrzu, podczas gdy aminokwasy hydrofilowe prawdopodobnie stykają się ze środowiskiem wodnym.
Wartości w poniższej tabeli są znormalizowane w taki sposób, że najbardziej hydrofobowa reszta ma wartość 100 w stosunku do glicyny, która jest uważana za neutralną (wartość 0). Skale zostały ekstrapolowane na reszty, które są bardziej hydrofilowe niż glicyna.
Wartości ApH 2: Znormalizowane na podstawie Sereda et al., J. Chrom. 676: 139-153 (1994).
Wartości BpH 7: Monera et al., J. Protein Sci. 1: 319-329 (1995).
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?